Кислоты и основания
Теория Аррениуса
В 1887 году была предложена первая теория кислот и оснований ученым Аррениусом. Ее полное название – теория электролитической диссоциации Аррениуса. Согласно этой теории:
Кислоты — вещества, способные диссоциировать с образованием протона;
H2SO4 ↔ 2H+ + SO+4
HBr ↔ H+ + Br—
Здесь протоном является атом водорода, как и у всех кислот.
Основания – вещества, диссоциирующие с образованием гидроксид-аниона.
NaOH ↔ Na+ + OH—
NH4OH ↔ NH+4 + OH—
OH— — это гидроксид-ион.
Современные представления о кислотах и основаниях оказались значительно шире. Многие вещества, ранее классифицированные как кислоты или основания, не соответствуют этим критериям. Например, аммиак, хотя и является основанием, не образует гидроксид-анион (см пример в теории Бернстада). Кроме того, теория Аррениуса не учитывает ситуации, когда реакции происходят в неводных средах.
Теория Брёнстеда–Лоури
В связи с этим, в 1923г учеными Бренстедом и Лоури была предложена другая теория названная, протолитической теорией кислот и оснований.
Согласно теории:
- Кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили общее название протолитов.
Схему реакции можно представить в следующем виде:
кислота ↔ основание + H+
- Каждой кислоте соответствует сопряженное с ней основание и наоборот. Это называется кислотно-основная пара.
В реакциях диссоциации
H3O+ ↔ H+ + H2O
H3O+ — это кислота, сопряженная основанию H2O
HCl ↔ H+ + Cl—
Cl— — основание, сопряженное кислоте HCl
Как было показано в общей схеме реакции, в растворе появляется свободный протон водорода. В таком виде он не может там оставаться и переходит к другому основанию, превращая его в кислоту:
кислота1 ↔ основание1 + H+
основание2 + H+ ↔ кислота2
равновесие между ними
кислота1 + основание2 ↔ основание1 + кислота2
В реакциях нейтрализации
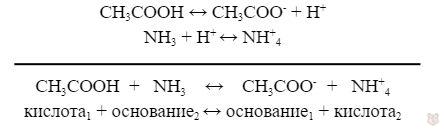
Уксусная кислота отдает протоны и является кислотой, аммиак – основанием, так как принимает протоны. Ион CH3COO— играет роль основания, так как он будет принимать протон водорода в обратном процессе. Ион аммония NH+4 будет играть роль кислоты, потому что он отдает протон водорода.
В реакциях автопротолиза
Вода — слабый электролит и обратимо диссоциирует в незначительной мере. Процесс диссоциации воды — автопротолиз.
H2О + H2О ↔ H3O+ + ОН–
осн.1 к-та2 к-та1 осн.2
ВОДА ТОЖЕ КИСЛОТА
В реакциях гидролиза
Растворитель здесь играет роль не только физической среды, но и как химическое вещество, которое реагирует с кислотой или основанием.
Диссоциация кислоты в воде
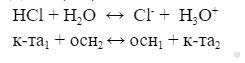
Растворение NH3 в воде:
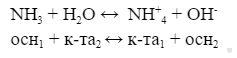
Исходя из примеров важно выделить, что кислотами могут быть не только привычные нам серная, соляная, азотная и др., но и вода, положительно заряженный ион аммония, в зависимости от того, кто отдает протоны и кто их принимает.
Для полного понимания картины и для понимания того, почему это правильно,
H2O ↔ H+ + OH— (здесь вода это кислота )
H2O + H+ ↔ H3O+ (здесь вода это основание)
следует уточнить, что существуют такие частицы, которые могут проявлять себя, в зависимости от условий, как кислоты и как основания. Они называются амфолитами.
Теория Гилберта Льюиса
В теории Г. Льюиса, кислота и основание определяются на основе обмена электронными парами, а не протонами водорода как в протолитической теории. В этой теории основание определяется как частица, содержащая неподелённую электронную пару, в то время как кислота представляет собой частицу, обладающую свободной орбиталью, на которую она способна принять неподелённую электронную пару. Такие частицы, будь то катионы, анионы или нейтральные молекулы, которые могут принять одну или несколько электронных пар, называются кислотами Льюиса.
Cu+2 + 4 :NH3 = [Cu(NH3)4]+2
В этом примере электронную пару от аммиака NH3 принимает ион меди Cu+2, значит он является кислотой, а аммиак основанием.
С точки зрения теории Льюиса, при образовании иона аммония NH+4, кислотой будет молекула аммиака NH3 с ее неподеленной электронной парой от атома азота,
а основанием будет ион водорода H+, который предоставит свою орбиталь неподеленной электронной паре от аммиака.
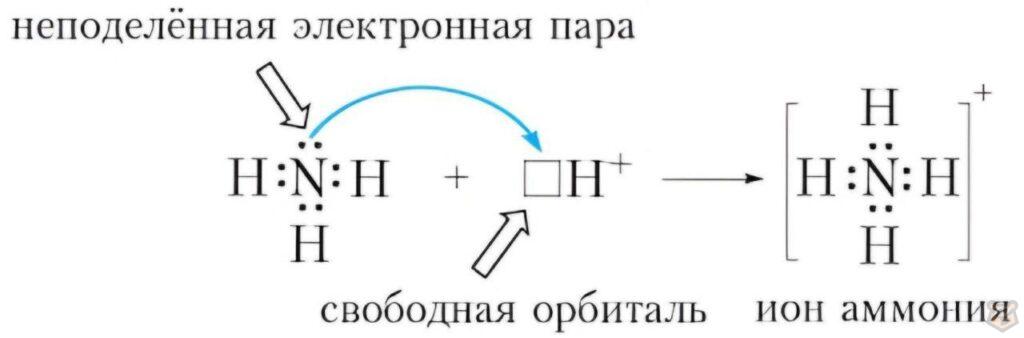
:NH3 + H+ = NH+4
осн + к-та
| Теория кислот и оснований | Кислота | Основание |
| Теория Аррениуса | Отдает H+ | Отдает OH— |
| Теория Брёнстеда–Лоури | Отдает H+ | Принимает OH— |
| Теория Гилберта Льюиса | Принимают электронные пары | Отдают электронные пары |
Мы выяснили, что бывают три разные теории и что они могут назначить роль кислоты и основания не только кислоте и основанию.
Теперь, где нам это может пригодиться на едином национальном тестировании?
Ответ: в тестовых заданиях на поиск значений pH и определение концентраций кислот и оснований, где теперь необязательно будут привычные нам кислота и основание, например, HCl и NaOH.
Немного о практике
Численно кислотно-основные свойства протолитов можно охарактеризовать константами равновесия.
CH3COOH ⇔ Н+ + СН3СОО–
к-та

Как правило, такие значения очень малы и с ними неудобно работать, сложно постоянно сравнивать. В связи с этим, было введено следующее обозначение
pКА = – lg KА
pKB = – lg KB
Так, на выходе получаются обычные целые числа.
В решении задач на концентрации через константы диссоциации играет большое значение ионное произведение воды.
В упрощенном виде диссоциация воды: H2О ⇔ H+ ОН–
Согласно ЗДМ (закон действующих масс):
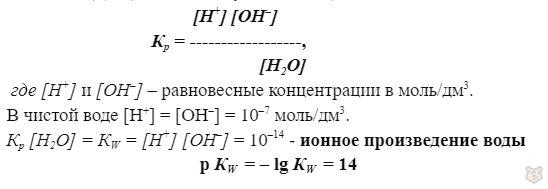
Именно благодаря этому произведению мы можем определить концентрацию катиона водорода, зная концентрацию гидроксид группы OH—.
Итак, разберем на примере заданий ЕНТ
Дана концентрация ионов в растворе, она равна 2.3*10-8 моль/л, определить pH раствора?
Решение:
Здесь мы как раз и воспользуемся ионным произведением воды.
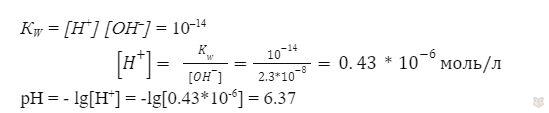
Ответ: pH = 6.37.
Определить pH 0,7 молярного раствора HClO3, Kд = 4.3*10-8 .
Решение:
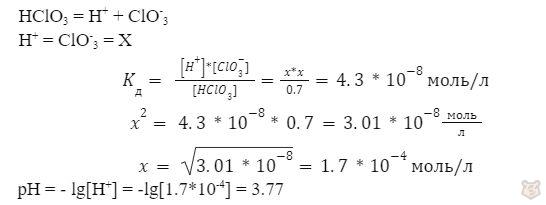
Ответ: pH = 3.77
Определить молярную концентрацию серной кислоты H2SO4 если известно, что pH = 1.3
Решение:

Ответ: C (H2SO4) = 0.02505 моль/л

