Спирты
В этой статье мы изучим классификацию и химические свойства спиртов.
Спирты относятся к кислородсодержащим органическим соединениям. В таких соединениях функциональные группы содержат кислород.
Гидроксильная группа (-OН) является функциональной группой спиртов и фенолов.
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
По количеству гидроксильных групп в молекуле все спирты делятся на одноатомные и многоатомные. По типу углеводородного радикала спирты можно разделить на: предельные, непредельные и ароматические. Соединения, имеющие общую формулу СnН2n+1ОН, или ROH, называются предельными одноатомными спиртами.
Спирты образуют гомологический ряд, в котором каждый последующий член отличается от предыдущего на гомологическую разность CH2-.
Для того, чтобы показать, что в молекуле спирта содержится гидроксильная группа (гидроксогруппа) -ОН, соединенная с углеродным радикалом, молекулярную формулу соответствующего спирта пишут в виде развернутой структуры, например для этанола: СН3ーCH2ーOH или в виде молекулярной формулы C2Н5ОН.
Рассмотрим сначала одноатомные спирты.
Гомологический ряд спиртов. Первый член ряда здесь метиловый спирт, имеющий следующую развернутую структурную формулу:
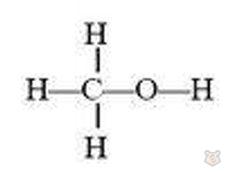
Ближайший следующий гомолог этилового спирта — пропиловый спирт с представленной ниже структурной развернутой формулой:
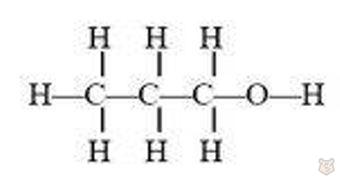
У спиртов данного гомологического ряда есть два вида изомерии: изомерия углеродного скелета и изомерия положения гидроксильной группы. Изучим ее на примере бутиловых спиртов.
В зависимости от строения углеродного скелета изомерами являются производные бутана и изобутана:
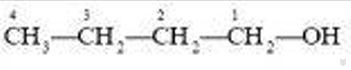
изобутанол-1 или н-бутиловый спирт
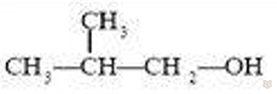
2-метилпропанол-2
В зависимости от положения ОН-группы возможны еще два изомера:
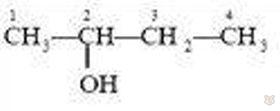
бутанол-2
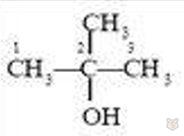
2-метилпропанол-2
Нумерацию углеродных атомов начинают с того конца, к которому ближе функциональная группа.
В зависимости от того, при каком углеродном атоме стоит гидроксильная группа, различают первичные, вторичные и третичные спирты.
Физические свойства. Спирты, содержащие в молекуле до 12 углеродных атомов. являются жидкостями, более 12 — твердыми веществами. Все они легче воды.
Низшие спирты, до пропилового включительно, смешиваются с водой в любых соотношениях. С повышением молекулярной массы растворимость спиртов в воде уменьшается. Спирты имеют высокую по сравнению с алканами или галогеналканами (при равных молярных массах) температуру кипения. Причина этого — ассоциация молекул спирта из-за образования между ними водородной связи.
Водородная связь может возникнуть как между молекулами спирта, так и между молекулами спирта и воды.
Метанол, этанол и пропанол имеют специфический алкогольный запах. у следующих за ними гомологов сильный запах, у некоторых неприятный. Высшие спирты запаха не имеют.
Метанол (метиловый спирт) СН3ОН очень ядовит. Уже небольшая его доза может вызвать слепоту или оказаться смертельной.
Химические свойства.
1. Кислотные свойства спиртов выражены слабо. Водные растворы спиртов на индикаторы не действуют.
2. Атом водорода гидроксильной группы спирта обладает некоторой подвижностью и способен вступать в реакции замещения. Так, в результате взаимодействия спиртов со щелочными металлами образуются алкоголяты и выделяется водород:
2C2Н5ОН + 2Na → 2C2Н5ОNa + H2↑
этилат натрия
Для того, чтобы понять причину того, что в молекуле спирта атом водорода, соединенный с углеродным радикалом через атом кислорода, обладает особыми свойствами (подвижностью), рассмотрим электронную формулу соединения. Она выглядит следующим образом:
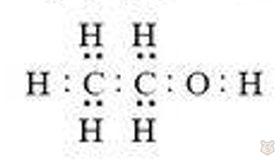
Связи между атомами СーС, СーН и ОーН являются σ-ковалентными. Однако связь ОーН ковалентная полярная, наибольшая электронная плотность ее смещена к атому кислорода как элементу более электроотрицательному. Атом водорода оказывается более свободным от электронов, менее связанным с молекулой и поэтому может сравнительно легко вытесняться натрием. Смещение электронной плотности в молекуле можно показать так:
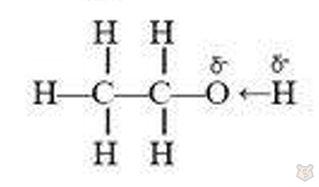
3. В присутствии концентрированной серной кислоты спирты реагируют с галогеноводородными кислотами, вследствие чего образуются галогенопроизводные углеводородов:
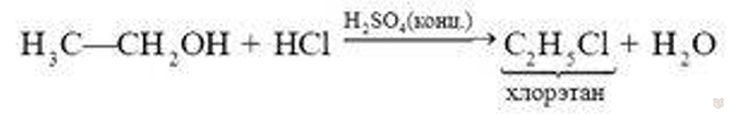
4. В присутствии водоотнимающих веществ и при повышенной температуре спирты подвергаются реакции дегидратации, в результате реакции образуется соответствующий алкен:
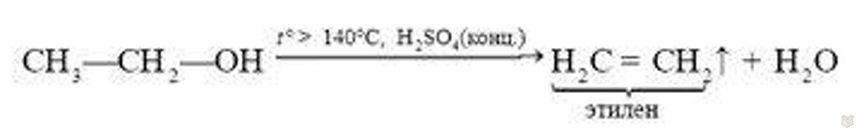
При избытке спирта и более низкой температуре получаются простые эфиры:
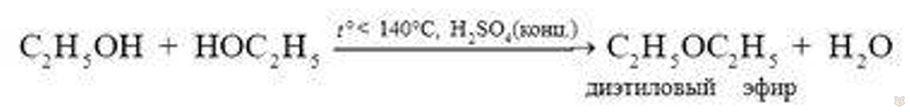
5. Спирты подвергаются окислению. При окислении первичных спиртов происходит образование альдегидов. Если, например, в этанол опустить прокаленную медную спираль, покрытую оксидом меди (II), то спираль становится блестящей, появляется специфический неприятный запах ацетальдегида:
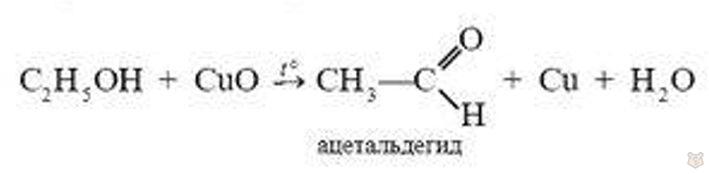
6. Также спирты сгорают в кислороде, при этом наблюдается выделение большого количества тепла. Чем больше молекулярная масса спирта, тем хуже он горит. При сгорании спиртов образуются углекислый газ и вода. Так, при сжигании этанола протекает следующая реакция:
C2Н5ОН + 3О2 → 2СО2↑ + 3Н2О
7. При реакции спиртов с карбоновыми кислотами происходит образование сложных эфиров:
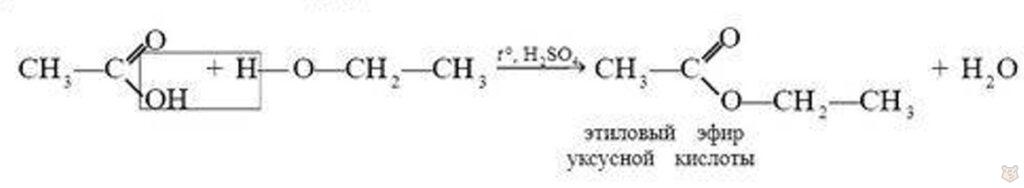
Эта реакция получила название реакции этерификации.
8. Спирты можно подвергать реакциям дегидрирования и дегидратации:
Промышленное производство этилового спирта. В промышленности этиловый спирт (этанол) получают различными способами. Наиболее старый из них заключается в отгонке спирта из вина, который образуется при брожении сахаристых веществ.
Позднее процесс брожения был применен для промышленного получения спирта из крахмалсодержащих продуктов. По этому способу крахмал или семена злаков превращают сначала в мальтозу, которую затем при помощи дрожжей сбраживают в спирт. Дрожжевые грибки вырабатывают ферменты, которые являются биокатализаторами процесса брожения. В результате образуется этиловый спирт и выделяется углекислый газ:
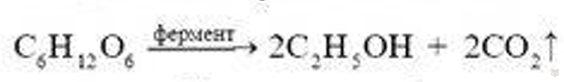
Спирт, полученный этим способом, отличается особой чистотой и применяется в пищевой промышленности и медицине.
Однако производство этилового спирта по этому способу требует большого расхода пищевого сырья.
Именно поэтому в промышленных масштабах этиловый спирт получают гидролизом целлюлозы:
(C6H10О5) + nH2О = nC2Н5ОН
Полученный спирт называют гидролизным спиртом.
Наиболее совершенным способом получения спирта является синтетический. Он заключается в каталитической гидратации этилена водяным паром:
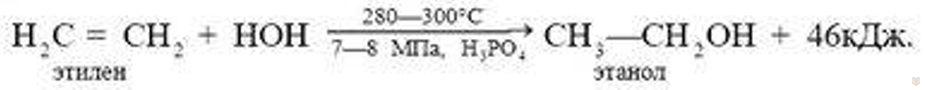
Эта реакция обратима. Так как этилен и вода взаимодействуют в газообразном (парообразном) состоянии и реакция в этом направлении ищет с уменьшением числа молекул, то смещению равновесия в сторону образования спирта содействует повышение давления. Для того чтобы при этом реакция шла с достаточной скоростью, необходимо воспользоваться катализатором и нагревать вещества. Но ввиду того, что реакция экзотермическая, сильное нагревание вызывает разложение образовавшегося спирта и равновесие смещается в обратном направлении.
Установлено, что оптимальными условиями гидратации этилена являются температура 280-300°С и давление 7-8 MПa, катализатором реакции служит фосфорная кислота, нанесенная на силикагель, активированный уголь или асбест.
Контактный аппарат для синтеза этилового спирта представляет собой цилиндрическую полую стальную колонну высотой около 10 м. Изнутри он футерован листовой медью с целью предохранения его от коррозии и заполнен слоем катализатора.
Этилен нагревается в теплообменнике до необходимой температуры, смешивается с перегретым водяным паром и поступает в верхнюю часть контактного аппарата. Продукты реакции отводятся из нижней части аппарата. В их составе пары этилового спирта, непрореагировавшие вещества и побочные продукты (диэтиловый эфир). Эта реакция осложняется параллельной реакшей образования диэтилового эфира.
Все последующие операции направлены на выделение чистого этилового спирта из этой смеси. Прежде всего продукты реакции обрабатываются щелочью с целью нейтрализации уносимой частично фосфорной кислоты. Затем они поступают в теплообменник, где охлаждаются, отдавая теплоту реакции этилену, поступающему на гидратацию. Схема данного процесса представлена ниже на рисунке 1.
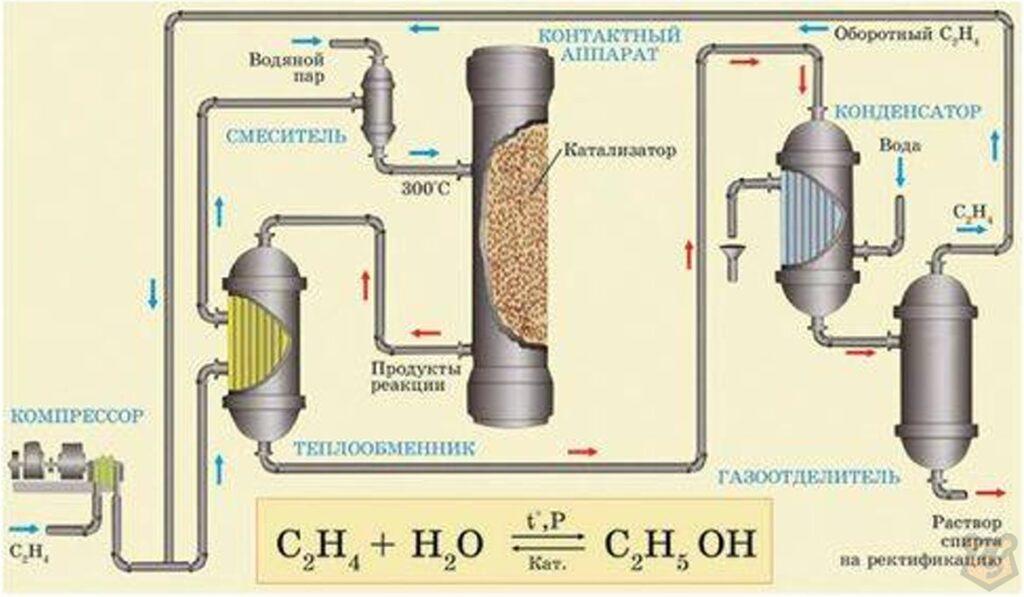
Рисунок 1 — Производство этанола гидратацией этилена
Применение. Спирты широко используются в виде растворителей в органическом синтезе, при производстве кислот и других веществ.
Они также применяются в производстве лекарств, косметики, парфюмерии, медицинских препаратов, духов и многих других продуктов. Спирты находят широкое применение как антисептики для дезинфекции поверхностей и рук. Они также используются в производстве красок, лаков, растворов для чистки и др. Таким образом, спирты играют важную роль в различных отраслях промышленности и науки.
Метиловый спирт используется для производства полимерных материалов, этиловый — для получения формальдегида, синтетического каучука, уксусной кислоты, диэтилового эфира.
В пищевой промышленности этанол используется для производства алкогольных напитков. Этот вид спирта также может использоваться в качестве консерванта для сохранения пищевых продуктов, таких как соусы, маринады и варенье.
Кроме того, этанол является эффективным дезинфицирующим средством для медицинских целей. Он может быть использован для обработки кожи перед инъекциями, для дезинфекции медицинского оборудования или для очистки ран и поверхностей перед хирургическими вмешательствами.
Важно помнить, что употребление этанола является опасным для здоровья. Этиловый спирт крайне негативно воздействует на организм человека. Повышенное содержание этанола вызывает спазм сосудов и сердечной мышцы, возникает вероятность закупорки сосудов и острой сердечной недостаточности. Спирт быстро воздействует на мозг, замедляет активность нервных клеток, выключается кора головного мозга, человек теряет контроль над собой, утрачивает способность рассуждать.
Пентиловые спирты применяют при производстве сложных эфиров, необходимых в парфюмерии. Изопентиловый спирт — реагент для определения жирности молочных продуктов.
Далее изучим характеристику и свойства многоатомных спиртов.
Строение. Многоатомные спирты содержат в молекуле несколько гидроксильных групп, соединенных с углеводородным радикалом.
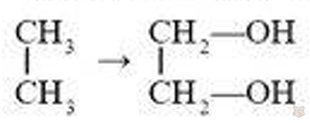
Формулы многоатомных спиртов, как и одноатомных. можно вывести из формул соответствующих углеводородов, заменяя в них атомы водорода гидроксильными группами. Если в молекуле углеводорода заменены гидроксильными группами два атома водорода, то получится формула двухатомного спирта. Простейшим представителем таких спиртов является этиленгликоль (этандиол-1,2), имеющий формулу:
Если в молекуле углеводорода заменены гидроксильными группами три атома водорода, то образуется трехатомный спирт. Например, из формулы пропана можно вывести формулу простейшего трехатомного спирта — глицерина (1,2,3-пропантриола):
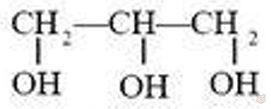
Известны спирты и большей атомности. Во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода.
По международной номенклатуре названия многоатомных спиртов состоят из названия соответствующего алкана путем добавления суффиксов -диол-, -триол- и т. д., затем через дефис цифрами указывают положение гидроксильных групп в углеродной цепи. У многоатомных спиртов имеет место изомерия углеродного скелета и изомерия положения гидроксильных групп.
Получение. Как нам известно, этиленгликоль образуется при окислении этилена перманганатом калия. Как и одноатомные спирты, многоатомные представители спиртов этиленгликоль и глицерин могут быть получены из соответствующих углеводородов из их галогенопроизводных:
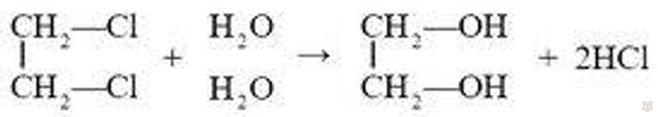
Глицерин получают расщеплением растительных и животных жиров.
Физические свойства. Этиленгликоль и глицерин представляют собой бесцветные жидкости, напоминающие сироп, имеют сладковатый вкус. Обладают хорошей растворимостью в воде и этаноле. Этиленгликоль кипит при 197,6°С, а глицерин — при 290°С.
Стоит отметить, что этиленгликоль является ядовитым веществом, поэтому необходимо соблюдать меры предосторожности при его использовании. Глицерин же считается безопасным для человека.
Химические свойства. Как вещества, содержащие гидроксильные группы, многоатомные спирты имеют сходные свойства с одноатомными спиртами.
Например, натрий вытесняет из них водород:
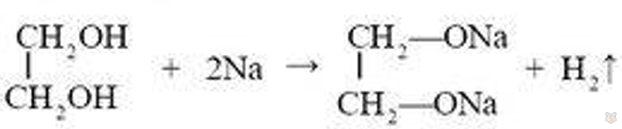
При действии галогенопроизводных кислот на спирты происходит замещение гидроксильной группы:
CH2OHーCH2OH + HCI → CH2OHーCH2CI + H2O
Для многоатомных спиртов характерны и некоторые специфические свойства. Если к свежеприготовленному гидроксиду меди (II) в присутствии щелочи прилить глицерин и смесь встряхнуть, то осадок растворяется и образуется прозрачный раствор глицерата меди ярко-синего цвета:
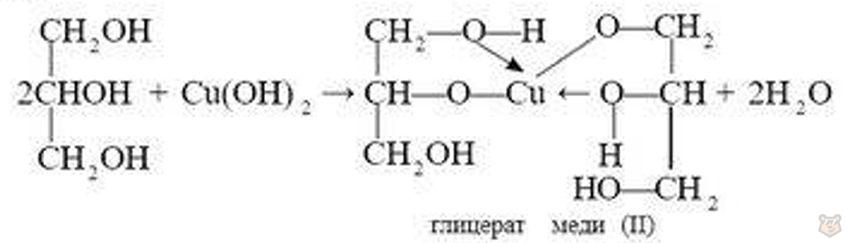
Эта реакция является качественной для многоатомных спиртов.
Взаимодействие глицерина с органическими и неорганическими кислотами приводит к образованию сложных эфиров. При взаимодействии глицерина с азотной кислотой образуется нитроглицерин — сложный эфир азотной кислоты и глицерина:
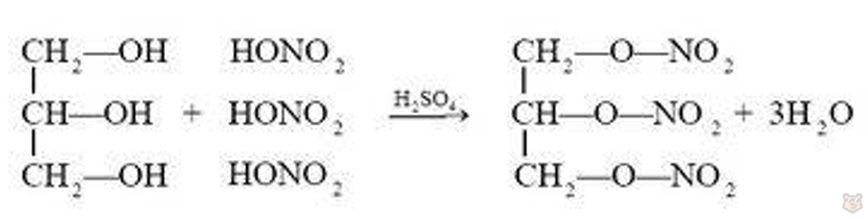
Однако название «нитроглицерин» историческое и не соответствует строению молекулы этого вещества.
Применение. Этиленгликоль используют (лавсана) и как антифриз (незамерзающая в радиаторах автомобилей), используемый в радиаторах автомобилей.
66%-ный водный раствор этиленгликоля замерзает только при 60°С. Добавка глицерина к этиленгликолю удлиняет срок службы водяных насосов автомашин.
Глицерин используют в получении нитроглицерина и динамита, для приготовления антифризов, в парфюмерной и пищевой промышленности, в медицине для приготовления мазей, которые смягчают кожу. B текстильной промышленности он помогают улучшить качество тканей, сделать их более приятными на ощупь и удобными в ношении. В медицине 1%-ный раствор и таблетки нитроглицерина служат в качестве средств, расширяющих кровеносные сосуды.
Генетическая связь между спиртами и углеводородами. Выше мы видели, что спирты можно рассматривать как производные углеводородов, содержащие гидроксильные группы.
Непосредственно заменить атом водорода на гидроксильную группу или внедрить атом кислорода в молекулу углеводорода довольно трудно. поэтому процесс осуществляется через галогенопроизводные. Например, чтобы получить этиловый спирт из этана, надо сначало получить бромэтан:
C2H6 + Br2 → C2H5Br + HBr
а затем бромэтан превратить в спирт, нагрев воду и используя щелочи:
C2H5Br + HOH ↔ C2H5OH + HBr
Щелочь играет роль катализатора в этом процессе, ускоряя реакцию и повышая ее эффективность. Кроме того, она помогает управлять pH реакционной среды, обеспечивая оптимальные условия для протекания химической реакции. В итоге можно достичь высокой конверсии и выхода нужного продукта.
Задания для самопроверки:
Задание 1
Третичный спирт:
А) гексанол-3
В) пропанол-1
С) 3-метилпропанол-3
D) пропанол-2
E) 3-метилпропанол-2
Задание 2
Продукт Х в цепочке превращений пропанол-1 → Х → 2-хлорпропан:
А) пропин
В) пропан
С) этилен
D) 1,2-дихлорпропан
E) пропен
Задание 3
Изомерами являются:
А) фенол и гексанол
В) пропанол и метилэтиловый эфир
С) пропанол и метанол
D) этанол и этилацетат
E) этанол и фенол
Задание 4
Этанол вступает в реакцию этерификации с:
А) О2
В) СН3СОН
С) Н2О
D) НСООН
E) CH3ОН
Задание 5
Водород взаимодействует с этим соединением с образованием спирта:
А) этаналь
В) этилен
С) этанол
D) диэтиловый эфир
E) нитроэтан
Ответы:
1 – C, 2 – E, 3 – B, 4 – D, 5 – A.
