Предельные углеводороды
Углеводороды классифицируются на предельные, непредельные и ароматические.
Предельные углеводороды, или алканы, — соединения с общей формулой CnH2n+2, где n — число атомов углерода.
Строение алканов
Связи между атомами алканов являются одинарными (σ-связи).
Атомы углерода в предельных углеводородах имеют гибридизацию sp3.
На рисунке ниже представлено образование связи между атомами углерода, при котором происходит смешение орбиталей.
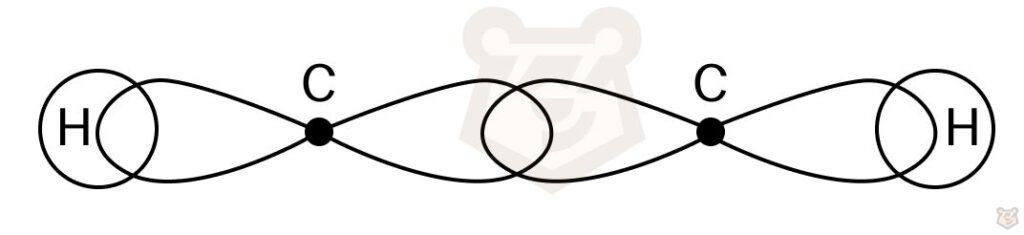
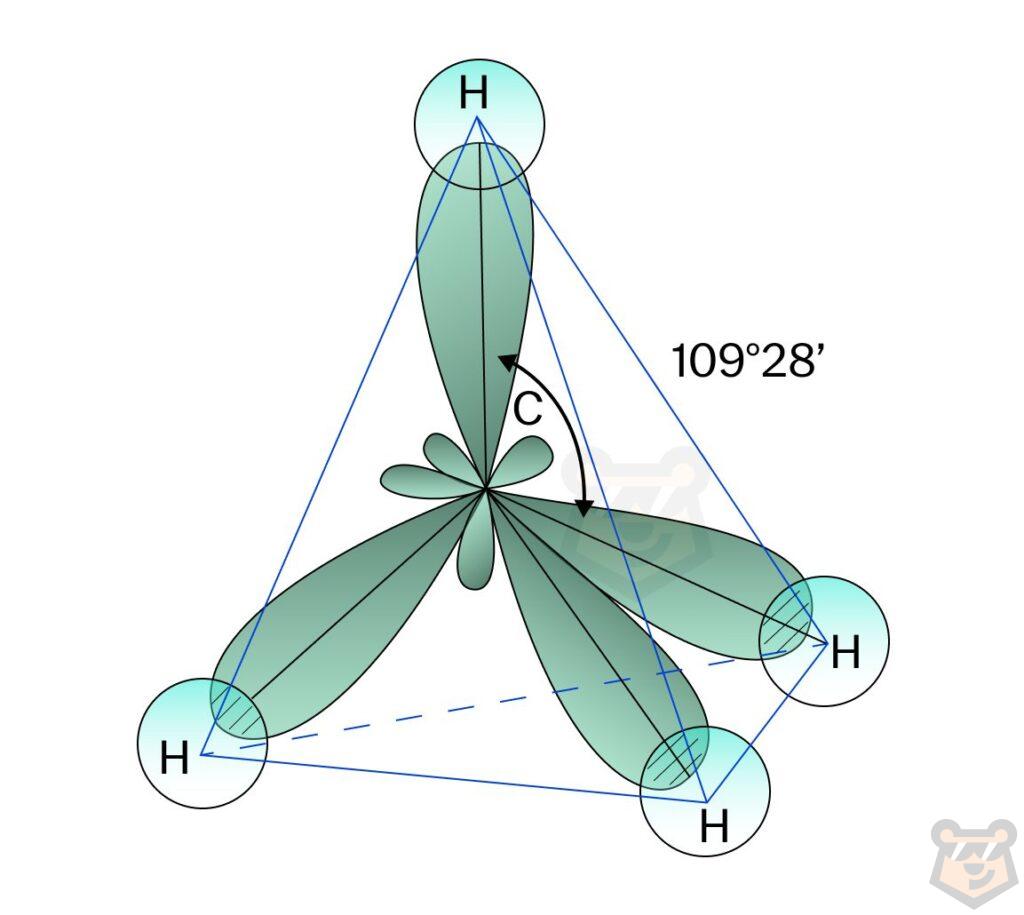
Алканы имеют тетраэдрическую пространственную конфигурацию. К примеру, в молекуле метана имеется четыре атома водорода и один атом углерода. В результате получаются 4 гибридизованные орбитали, отталкивающиеся друг от друга под валентным углом, равным 109°28′. Ниже представлена пространственная конфигурация метана в форме тетраэдра.
Номенклатура алканов
Номенклатура гомологического ряда алканов представлена ниже в таблице. Название определенного алкана образуется путем добавления суффикса “-ан”.
| Название алкана | Формула алкана |
| Метан | CН4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
В следующей таблице представлено число структурных изомеров у представителей непредельных углеводородов. Как можно заметить, с ростом числа атомов углерода, возрастает количество структурных изомеров алканов.
| Количество изомеров в ряду алканов | |
| Молекулярная формула | Число структурных изомеров |
| СН4 | 1 |
| С2Н6 | 1 |
| С3Н8 | 1 |
| С4Н10 | 2 |
| С5Н12 | 3 |
| С6Н14 | 5 |
| С7Н16 | 9 |
| С8Н18 | 18 |
| С9Н20 | 35 |
| С10Н22 | 75 |
Для алканов характерна также пространственная изомерия.
Физические свойства алканов
В обычных условиях первые четыре члена гомологического ряда алканов являются газами. Алканы, имеющие от 5 до 15 атомов углерода, являются жидкостями. Представители, в составе которых от 16 атомов углерода, — твердые вещества.
Алканы — неполярные соединения. Жидкие алканы легко смешиваются друг с другом. Они легче воды и практически не растворяются в ней, в то время как хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан.
Жидкие алканы хорошо растворяют многие органические вещества. Метан и этан, а также высшие алканы не имеют запаха. Алканы являются горючими веществами. Метан при этом горит бесцветным пламенем.
Химические свойства алканов
Алканы обладают низкой реакционной способностью. Это обусловлено прочностью и малой полярностью связей между атомами углерода С-С и атомами углерода с водородом С-Н. В определенных условиях предельные углеводороды вступают в реакции замещения, отщепления, окисления и изомеризации. Рассмотрим эти реакции.
Реакции замещения
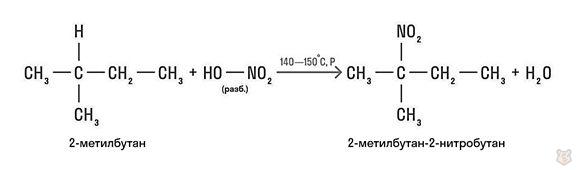
Реакция нитрования (реакция Коновалова)
Это реакция взаимодействия алканов с разбавленной азотной кислотой, протекающая при повышенной температуре и нормальном или повышенном давлении.
Галогенирование
Реакция взаимодействия с галогенами.
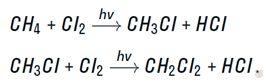
Реакция может продолжаться до полного замещения атомов водорода на хлор.
Сульфирование
При нагревании высшие алканы реагируют с концентрированной серной кислотой. При этом образуются сульфокислоты:
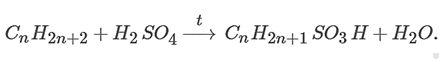
Реакции разложения
Дегидрирование (отщепление водорода)
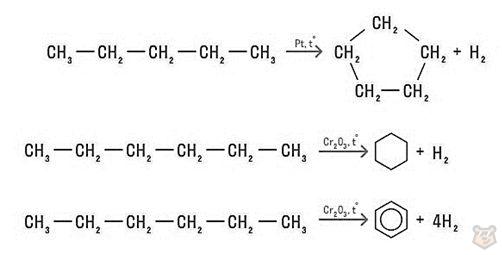
Реакция дегидрирования протекает под действием катализаторов, таких как платина, никель, палладий, оксид хрома (III), оксид железа (III), оксид цинка.
Крекинг:
Реакция крекинга проходит при нагревании алканов, для которых характерны длинные углеродные цепи. При этом образуется смесь алканов и алкенов с меньшими молекулярными массами.
Реакция крекирования алканов с четным количеством атомов углерода протекает симметрично с образованием соответствующих алканов и алкенов (у которых число атомов углерода становится вдвое меньше).
C8H18 → C4H10 + C4H8
Пиролиз метана:
Пиролиз метана может протекать при медленном и длительном нагревании с образованием углерода и водорода:
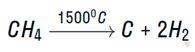
Либо при очень быстром нагревании с образованием ацетилена и водорода:
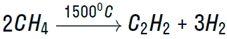
Реакция окисления
Горение
Алканы горят с образованием углекислого газа и воды по следующей общей схеме реакции:
CnH2n+2 + (1,5n + 0,5) O2 → nCO2 + (n+1) H2O
Исключение составляет метан, который горит с образованием угля и воды.
Каталитическое окисление
Алканы каталитически окисляются частично с образованием разных продуктов.
Например, при окислении бутана образуется уксусная кислота и вода:
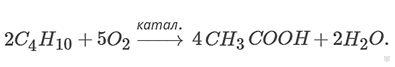
Важное промышленное значение имеет конверсия метана – реакция окисления метана водой:

В результате конверсии метана получают синтез-газ – смесь угарного газа (СО) и водорода.
Алканы не окисляются сильными окислителями, такими как перманганаты, дихроматы и хроматы.
Реакция изомеризации
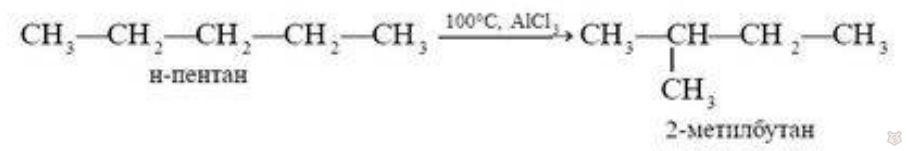
Алканы нормального строения при определенных условиях превращаются в изомеры с разветвленной цепью.
Ниже представлена реакция изомеризации н-пентана с образованием 2-метилбутана.
Получение алканов
Промышленные способы получения
В промышленности предельные углеводороды получают из горючих полезных ископаемых, таких как природный газ, нефть, каменный и бурый уголь.
Лабораторные способы получения
1. Нагревание солей карбоновых кислот со щелочью, реакция протекает по следующей общей схеме:
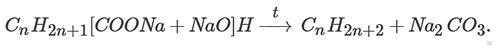
2. Реакция Вюрца — получение алканов из моногалогеналканов, при которой происходит удлинение углеродной цепи:
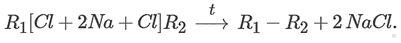
При взаимодействии одинаковых галогеналканов углеродная цепь удваивается. Например, в реакции Вюрца из хлорметана образуется этан:
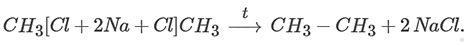
Если в реакции участвуют разные галогеналканы, происходит три реакции и образуется смесь алканов:
CH3Cl + 2Na + C2H5Cl → CH3-CH2-CH3 + 2NaCl
CH3Cl + 2Na + CH3Cl → CH3-CH3 + 2NaCl
C2H5Cl + 2Na + C2H5Cl → CH3-CH2-CH2-CH3 + 2NaCl
3. Алканы получают гидрированием ненасыщенных углеводородов (алкенов, алкинов, алкадиенов), реакция протекает под действием катализатора (платина, палладий) по следующей схеме:
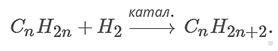
4. Получение метана из карбида алюминия:
Al4C3 + 12H2O → 3CH4 ↑ + Al(OH)3 ↓
Применение алканов
Алканы широко применяются в самых разнообразных сферах жизни.
Метан часто встречается в природе, является составной частью природного газа. Этот газ получил название “болотного газа” за то, что выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха. Метан постоянно скапливается в каменноугольных шахтах, поэтому его также называют рудничным газом. Метан не раз являлся причиной катастроф в рудниках.
Газообразные алканы широко применяются в быту в качестве топлива, содержатся в природном газе. Жидкие алканы входят в состав известных нефтепродуктов, таких как бензин, керосин, солярка, дизельное топливо, мазут. Нефть и природный газ являются источниками предельных углеводородов.
Декан является одним из углеводородов, который используется как растворитель красок, его другое название “уайт-спирит”.
Из твердых предельных углеводородов, в частности, из парафина, изготавливают свечи.
Задания для самопроверки:
Задание 1
Укажите молекулярную формулу этана:
A) C3H6
B) C6H6
C) C4H8
D) C2H6
Задание 2
Связи в молекуле алканов:
A) двойные
B) тройные
C) одинарные
D) полуторные
Задание 3
3. Молекула метана имеет форму:
A) пирамиды
B) тетраэдра
C) параллелепипеда
D) конуса
Задание 4
Природный газ содержит главным образом:
A) пропан
B) бутан
C) метан
D) пентан
Задание 5
Изомер пентана:
A) изобутан
B) 2-метилгексан
C) 3-метилпентан
D) 2,2-диметилпропан
Ответы:
1 – D, 2 – C, 3 – B, 4 – C, 5 – D.
