Непредельные углеводороды
В этой статье мы познакомимся с непредельными углеводородами, изучим их номенклатуру, изомерию, гомологи. Ознакомимся со свойствами ненасыщенных углеводородов и их применением.
Углеводороды, которые содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), называют непредельными, или ненасыщенными.
Такие молекулы содержат кратные связи, представляющие собой двойные и тройные связи между атомами углерода. Например, в молекуле этилена (C2H4) два атома углерода соединены двойной связью, а в молекуле ацетилена (C2H2) — тройной связью. В структурных формулах двойные связи изображаются двумя (=) или тремя (≡) черточками.
Эти кратные связи обусловлены тем, что углеродный атом стремится образовать четыре валентные связи и достичь октета электронов во внешнем энергетическом уровне. Поэтому, если в молекуле имеется двойная или тройная связь, это означает, что каждый углеродный атом удовлетворяет свои валентность, образуя соседние атомы.
Наличие кратных связей обуславливает непредельный характер данных углеводородов, так как в таких соединениях не все атомы углерода насыщены водородом. Поэтому их и называют непредельными или ненасыщенными. Эта особенность структуры непредельных углеводородов делает их более реакционноспособными по сравнению с предельными углеводородами. Особую активность непредельные соединения проявляют в реакциях присоединения, например:
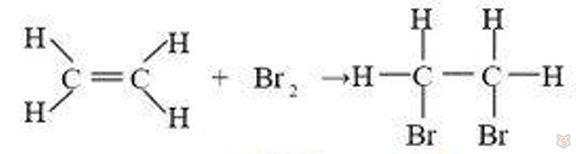
Реакция выше демонстрирует взаимодействие этилена с бромной водой, при котором образуется соединение дибромэтан.
Таким образом, если пропустить этилен или ацетилен через бромную воду, бромная вода в ходе реакции обесцвечивается. Это доказывает, что углеводороды с двойной или тройной связью ненасыщенные, т. е. они легко присоединяют галогены.
Одним из видов непредельных углеводородов являются алкены.
Углеводороды с общей формулой СnН2n, в молекуле которых между атомами углерода имеется одна двойная связь, называют алкенами.
Изомерия и номенклатура алкенов. Гомологический ряд алкенов начинается с этена (этилена). Последующие члены ряда образуются прибавлением к этену гомологической разности СН2. Названия алкенов происходят от названий соответствующих алканов замещением суффикса -ан на -ен или на -илен. Номенклатура алкенов представлена ниже в таблице 1.
Таблица 1 — Номенклатура алкенов
| Молекулярная формула алкена | Название алкена | |
| Международная номенклатура | Тривиальное (традиционное) | |
| С2Н4 | Этен | Этилен |
| С3Н6 | Пропен | Пропилен |
| С4Н8 | Бутен | Бутилен |
| С2Н4 | Пентен | Амилен |
Одновалентный радикал этилена СН2=СН- называется винилом.
Изомерия алкенов существенно богаче, чем алканов. Для алкенов возможны четыре типа изомерии: изомерия положения двойной связи, изомерия углеродной цепи, межклассовая изомерия, а также геометрическая изомерия.
Изомеры начинаются с четвертого члена ряда алкенов С4Н8.
Ниже на рисунке 1 приведены в виде схемы изомеры бутена С4Н8:
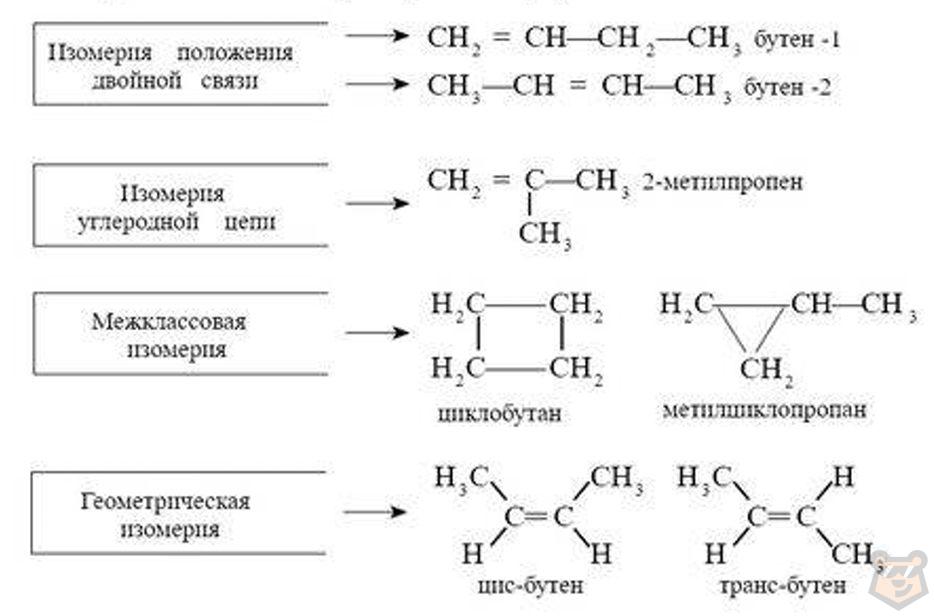
Рисунок 1 — Изомеры бутена
В этиленовых углеводородах свободное вращение по месту двойной связи не представляется возможным, следовательно, водородные атомы и группы атомов у кратной связи в пространстве располагаются по-разному. При этом возникает цис-транс -изомерия.
Цис-транс-изомерию рассмотрим на примере бутена-2: в случае, если оба атома водорода у атомов углерода с двойной связью окажутся по одну сторону от двойной связи — это будет цис-изомер, в случае же, при котором атомы водорода будут по разные стороны от двойной связи, образуется транс-изомер. Данные виды изомеров приведены на рисунке 1 выше в графе “Геометрическая изомерия”.
Рассмотрим алгоритм составления по международной номенклатуре названий алкенов. Определенный алкен представлен на рисунке 2 ниже.
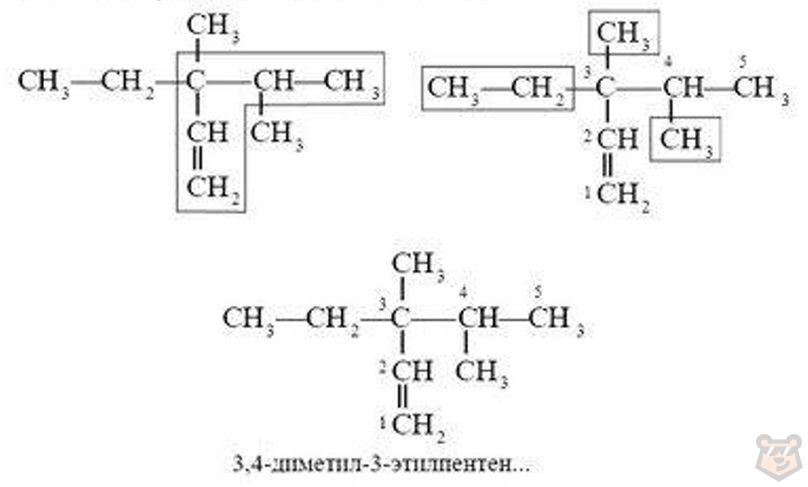
Рисунок 2 — Название алкена по международной номенклатуре
Итак, что по порядку необходимо сделать, чтобы правильно назвать соответствующий алкен:
- Найти наиболее длинную (главную) цепь углеродных атомов, которая содержит двойную связь.
- Пронумеровать цепь, начиная с того конца, к которому ближе двойная связь.
- Назвать в алфавитном порядке заместители (алкильные радикалы) и алкен, соответствующий главной цепи.
- После наименования главной цепи указать цифрой положение двойной связи.
Таким образом, можно выделить следующие особенности двойной связи:
— состоит из σ-связи и π-связи;
— самопроизвольный поворот атомов относительно двойной связи не происходит;
— энергия двойной связи больше, чем одинарной;
— двойная связь поляризуется легче, чем одинарная.
Физические свойства алкенов. У этиленовых углеводородов физические свойства закономерно изменяются в гомологическом ряду подобно предельным углеводородам.
Этилен — это бесцветный газ, имеющий весьма слабый сладковатый запах, немного легче воздуха, малорастворим в воде.
В целом алкены мало растворимы в воде, но хорошо растворимы в органических растворителях. Все они также хорошо горят.
Химические свойства углеводородов ряда этилена. По сравнению с алканами, алкены обладают большей реакционной способностью. Это объясняется наличием двойной связи в данных соединениях.
Характерными реакциями для них являются реакции присоединения по двойной связи.
Реакции электрофильного присоединения к алкенам. Рассмотрим типичную реакцию электрофильного присоединения брома к этилену. Данная реакция протекает по следующему уравнению:
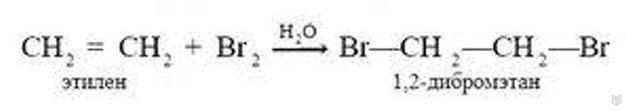
Этилен легко бромируется даже при комнатной температуре. Как мы знаем, вода — это полярный растворитель. Поэтому она реагирует с неполярными молекулами типа Br2, при этом поляризует их (т.е. так смещает электронную плотность связи между атомами брома Вr-Br, поэтому возникают частичные заряды) и в итоге атомы брома распадаются по ионному механизму, но не по радикальному. Этот механизм протекает в следующем виде:
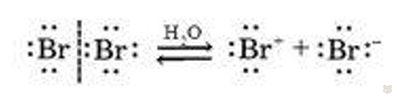
Частица Вr— — это активный электрофил. Далее происходит атака Вr+ по π-связи с образованием карбокатиона Вг-CH2-CH2+. Этот карбокатион уже присоединяет ион Вr— с образованием конечного продукта 1,2-дибромэтана.
Бромная вода (раствор брома в воде) представляет собой раствор бурого или буровато-желтого цвета и может использоваться в качестве качественной реакции для обнаружения двойных и тройных связей в органических соединениях. При взаимодействии бромной воды с углеводородами, содержащими кратные связи, происходит обесцвечивание раствора. Это происходит из-за того, что бром добавляется к двойной или тройной связи, образуя бесцветные соединения. Таким образом, если реакция с бромной водой приводит к обесцвечиванию, это указывает на наличие кратных связей в тестируемом углеводороде.
Молекула Br2 симметрична и после ее присоединения к алкену мы уже не можем знать, какой из атомов брома «работал» электрофилом.
Другое дело — молекулы НХ (НСІ, НВr, НІ) и Н2О (в присутствии сильной кислоты): здесь электрофилом всегда является ион водорода Н+. Он забирает пару электронов π-связи для образования связи С-Н. При этом заряд “+” возникает на соседнем атоме углерода. Данный механизм продемонстрирован ниже:
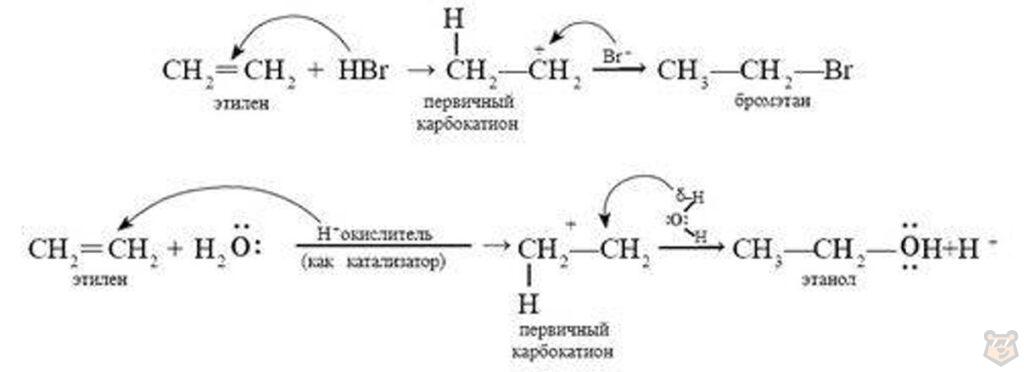
Карбокатион — это ион, в котором атом углерода образует трехвалентную положительно заряженную область, так как у него не хватает одного электрона для окончания октаэдрической оболочки. В случае молекулы этилена, оба атома углерода могут образовывать карбокатион, так как они одинаковы. Поэтому, электрофил может атаковать любой из атомов углерода, образуя один и тот же карбокатион.
Например, в реакции пропена с хлороводородом НСl образуется 2-хлорпропан и не образуется 1-хлорпропан. Это происходит потому, что промежуточным продуктом реакции образования 1-хлорпропана был бы менее устойчивый первичный карбокатион. Процесс его образования является менее энергетически выгодным.
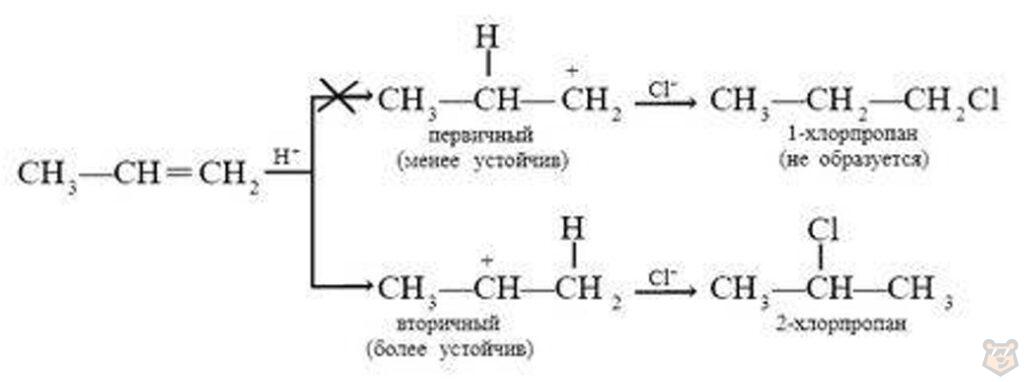
В. В. Марковников в 1869 г. предложил эмпирическое правило, согласно которому определяется направление таких реакций.
Правило Марковникова
При присоединении кислоты по двойной углерод-углеродной связи алкена водород кислоты присоединяется к атому углерода, который несет наибольшее число атомов водорода.
В современной формулировке правило Марковникова имеет следующее определение:
Электрофильное присоединение по двойной углерод-углеродной связи протекает через стадию образования наиболее устойчивого карбокатиона.
Реакции электрофильного присоединения воды к алкенам, в которых образуются спирты, называют реакциями гидратации алкенов. Они также подчиняются правилу Марковникова:
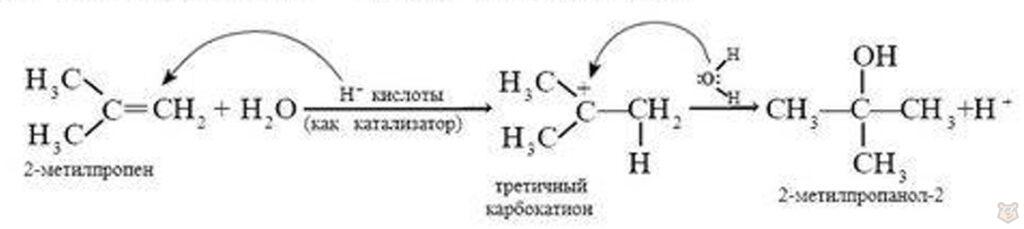
Наиболее легко образуются более устойчивые третичные карбокатионы, за ними следуют вторичные и т. д. Поэтому реакционная способность алкенов в реакциях электрофильного присоединения уменьшается в следующем ряду:
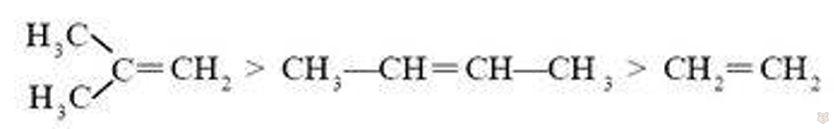
1. Присоединение водорода (гидрирование) протекает в присутствии катализатора (никель, палладий, платина):
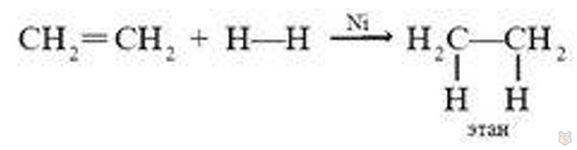
2. Присоединение воды (гидратация) протекает в присутствии катализатора (серная или фосфорная кислота):
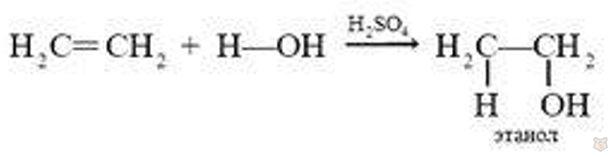
Во всех перечисленных реакциях происходит разрыв π-связи в молекуле этилена, остальные связи при этом остаются в неизменном состоянии.
В отличие от метана этилен горит светящимся пламенем из-за большего содержания в нем углерода, данная реакция протекает по следующему уравнению:
С2Н4 + 3О2 → 2СО2↑ + 2Н2О
Применение. Алкены являются важнейшими исходными веществами во многих отраслях современного органического синтеза. Используются в производстве полиэтилена, этилового спирта, этиленгликоля, дихлорэтана.
Этен (этилен) ускоряет созревание овощей и фруктов. Пропен перерабатывается в полипропилен, ацетон, изопропиловый спирт. Из бутенов производится синтетический полибутадиеновый каучук.
Теперь рассмотрим еще один класс предельных углеводородов — алкадиены или диены.
Алкадиены, или диеновые углеводороды — непредельные углеводороды, содержащие в углеродной цепи молекулы две двойные связи.
Поскольку в молекуле диенов появляется еще одна двойная связь, они имеют в своем составе на два атома водорода меньше, чем алкены. Общая формула диеновых углеводородов: CnH2n-2, где n > 3.
В зависимости от взаимного расположения двойных связей диены делятся на три группы. Данная классификация представлена ниже в таблице 2.
Таблица 2 — Классификация диеновых углеводородов
| Тип диена | Взаимное расположение двойных связей | Примеры |
| Кумулированные | Две двойные связи находятся рядом | CH2=C=CH2 Пропадиен |
| Сопряженные | Двойные связи разделены одной одинарной связью | CH2=CH-CH=CH2Бутадиен-1,3 |
| Изолированные | Двойные связи разделены двумя или более одинарными связями | CH2=CH-CH2-CH=CH2 Пентадиен-1,4 |
По систематической номенклатуре диеновые углеводороды называют так же, как и этиленовые, но только вместо суффикса -ен употребляют -диен. Положение каждой двойной связи обозначают цифрой.
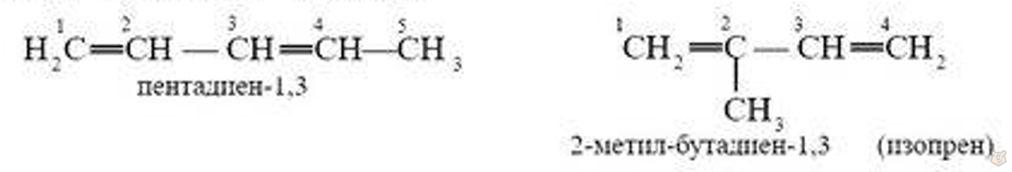
При построении названия симметричных денов их рассматривают как состоящие из двух радикалов — дивинил:
CH2=CH-CH=CH2
дивинил или бутадиен-1,3
Наибольшее практическое значение имеют сопряженные диены, например, бутадиен-1,3 и 2-метил-бутадиен-1,3 (изопрен) — важнейшие мономеры для производства синтетического каучука, данные соединения вырабатываются в промышленности в больших объемах.
Получение. В 1932 г. академик С. В. Лебедев разработал каталитический способ получения бутадиена из этилового спирта. При пропускании паров спирта над катализатором происходит одновременное отщепление молекул воды (дегидратации) и водорода (дегидрирования) от молекул спирта:
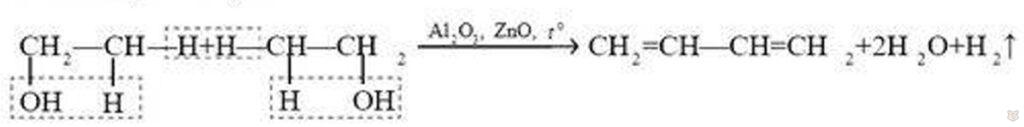
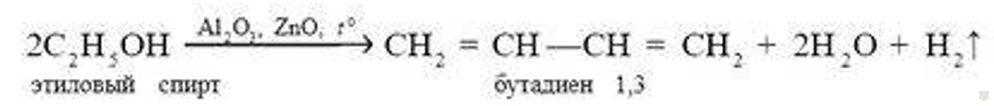
В настоящее время простейшие диены с сопряженными связями промышленности получают дегидрированием алканов, содержащихся в нефтяных газах. С этой целью бутан пропускают над нагретым катализатором — смесью оксидов алюминия и оксида хрома (III) до 560-620 ℃:
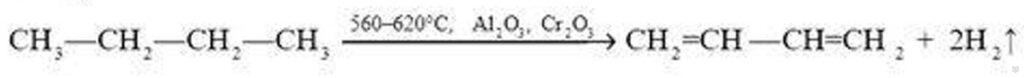
Изопрен получают дегидрированием 2-метилбутана, который входит в состав нефтяных газов и нефти. В качестве катализатора используется оксид хрома (III) Сr2О3:
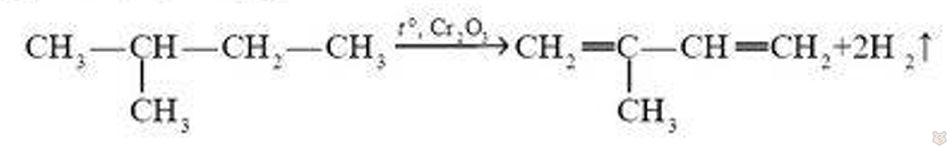
Физические свойства. При обычных условиях бутадиен является газом, при температуре –4,5°С превращается в жидкость, имеет характерный неприятный запах. Изопрен — летучая жидкость, кипящая при температуре 34,1 °С, имеющая неприятный запах.
Химические свойства. Химические свойства алкадиенов определяются наличием в их молекулах двойных связей. Подобно алкенам, алкадиены присоединяют водород, галогены, галогеноводороды, воду, причем 1 моль алкадиена присоединяет по 2 моль этих реагентов. Например, при пропускании бутадиена через бромную воду ее бурая окраска быстро исчезает. Образуются продукты присоединения по обеим двойным связям:
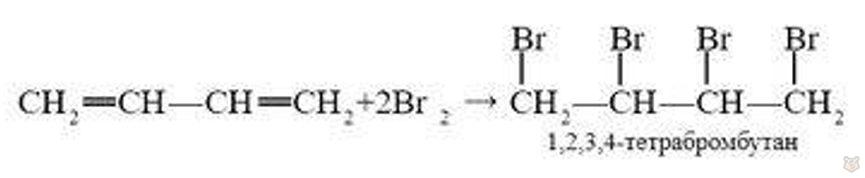
Если на 1 моль бутадиена взять 1 моль брома, то образуется смесь двух продуктов: 1,4-дибромбутена-2 и 1,2-дибромбутена-2.
У алкадиенов реакции присоединения могут протекать по двум направлениям:
1) по месту разрыва одной двойной связи (1,2-присоединение);
2) с присоединением к концам молекулы и разрывом двух двойных связей (1,4-присоединение):
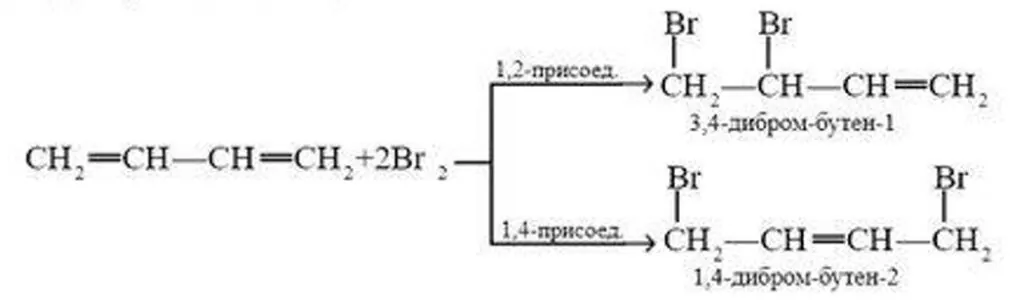
Галогеноводороды присоединяются к сопряженным алкадиенам преимущественно в положения-1,4:
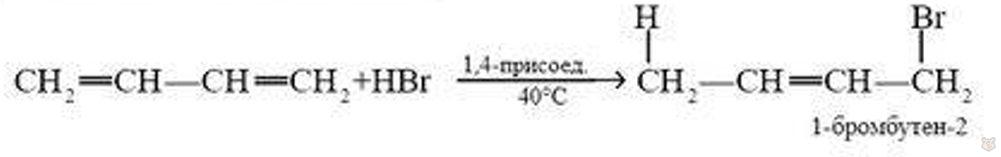
Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
Применение диенов. Производные бутадиена-1,3 и 2-метил-бутадиена-1,3 (изопрен) — важнейшие мономеры для производства синтетического каучука, в больших объемах вырабатываются в промышленности.
Рассмотрим следующий класс непредельных углеводородов — алкины.
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей одну тройную связь между атомами углерода и соответствующие общей формуле CnH2n-2, где n > 2.
Строение. Ацетилен С2Н4 — основной представитель алкиновых углеводородов. По названию первого представителя алкиновых углеводородов — ацетилена — эти углеводороды называют ацетиленовыми.
Структурная и электронная формулы ацетилена изображены ниже:
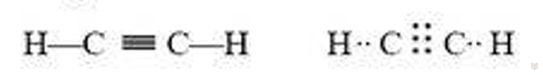
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sp-гибридизации, которая показана на рисунке 3 ниже.
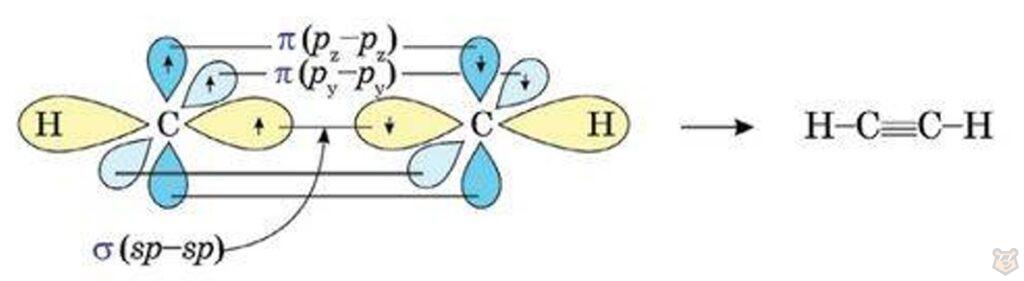
Рисунок 3 — Образование тройной связи у ацетилена
Данный тип гибридизации происходит, когда одна s-орбиталь и одна p-орбиталь объединяются для создания двух sp-гибридизованных орбиталей, в то время как две оставшиеся p-орбитали остаются негибридизованными. Это позволяет атому достичь оптимальной геометрии и обеспечить эффективное наложение орбиталей в молекуле.
Изомерия и номенклатура. Алкины, как и другие углеводороды, имеют гомологический ряд. Гомологический ряд алкинов представлен в таблице 3. В систематической номенклатуре ацетиленовые углеводороды называют, заменяя в названиях соответствующих алканов суффикс -ан на -ин: этан-этин, пропан-пропин и т.д.
Таблица 3 — Гомологический ряд алкинов
| Молекулярная формула алкина | Название алкина | |
| Международная номенклатура | Тривиальное(традиционное) | |
| С2Н2 | Этин | Ацетилен |
| С3Н4 | Пропин | Метилацетилен |
| С4Н6 | Бутин | — |
| С5Н8 | Пентин | — |
| С6Н10 | Гексин | — |
Нумерацию углеродной цепи начинают с той стороны, где ближе тройная связь и разветвления. Существует два типа изомерии алкинов: изомерия положения тройной связи (углеродного скелета) и изомерия цепи.
Изомеры алкинов рассмотрим на примере пентина С5Н8:
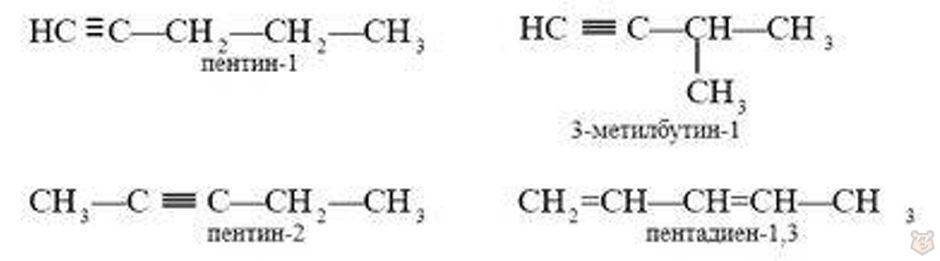
Алкины изомерны другому классу соединений — алкадиенам:
CH2=CH-CH=CH-CH3
пентадиен-1,3
В силу особенности строения тройной связи для алкинов невозможна пространственная цис-транс-изомерия.
Получение.
1. В промышленности ацетилен получают высокотемпературным разложением природного газа метана — при температуре 1500°С и быстро охлаждают, чтобы предотвратить разложение ацетилена:
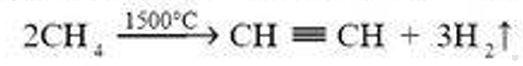
2. В технике ацетилен получают из карбида кальция, разлагая его водой:
CaC2 + 2H2О → CH ≡ CH + Ca(OH)2
Карбид кальция получают в электропечах при прокаливании кокса с негашеной известью:
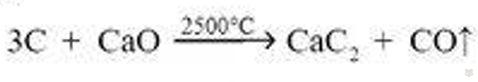
Теоретически 1 кг чистого карбида кальция должен давать 348 л ацетилена. Практически же получают 290-300 л (при нормальном давлении и 15°С) сырого ацетилена.
3. При нагревании этана до 1200°С он разлагается на ацетилен и водород:
C2Н6 → C2Н2↑ + 2Н2↑
4. В лаборатории ацетиленовые углеводороды можно получить
из дигалогенпроизводных алканов:
CHBr2-СН2-CH2 + 2КОН(спирт.р-р) → СН ≡ C ー СH3 + 2KBr + 2H2О
Физические свойства. Ацетилен представляет собой бесцветный газ, легче воздуха. Растворяется во многих жидкостях. Для получения растворенного ацетилена применяют ацетон, который при температуре 15°С растворяет до 23 объемов ацетилена. Но растворимость ацетилена в воде не слишком высокая. Этот газ хранят в стальных баллонах.
Алкины схожи по физическим свойствам с соответствующими алкенами. Низшие представители (до С4) представляют собой газы, не имеющие цвета и запаха, с более высокими температурами кипения, чем их аналоги в алкенах. Слабо растворяются в воде, гораздо лучше в органических растворителях.
Химические свойства. Ацетилен (этин) — наименьший и наиболее простой представитель алкинов. Он имеет формулу C2H2.
Гомологи ацетилена — это алкины с различным числом углеродных атомов в цепи. Например, пропин имеет формулу C3H4 и представляет собой простой гомолог ацетилена. Также существуют более длинные алкины, такие как бутин (C4H6), пентин (C5H8) и т. д.
Химическая активность ацетилена и его гомологов определена их тройной связью между углеродными атомами, которая делает их очень реакционноспособными. Они могут реагировать с различными соединениями, образуя новые органические продукты. Например, ацетилен может подвергаться реакциям присоединения с хлором, бромом или водой, образуя соответственно дихлорэтан, дибромэтан или ацетальдегид.
Причина активности ацетилена и его гомологов связана с тройной связью, поэтому для алкинов, как и для алкенов, характерны реакции присоединения.
Реакции присоединения. В этих реакциях алкины присоединяют не одну, а две молекулы реагента (водорода, галогена, галогеноводорода). При реакции присоединения тройная связь вначале переходит в двойную, а затем в простую (σ-связь). Кроме реакций присоединения ацетиленовые углеводороды вступают в реакции полимеризации, замещения и окисления.
1. Гидрирование. Реакция протекает в присутствии катализатора (Ni, Pt, Pd). При гидрировании ацетилена сначала образуется этилен (разрывается первая π-связь), а затем этан (разрывается вторая π-связь):
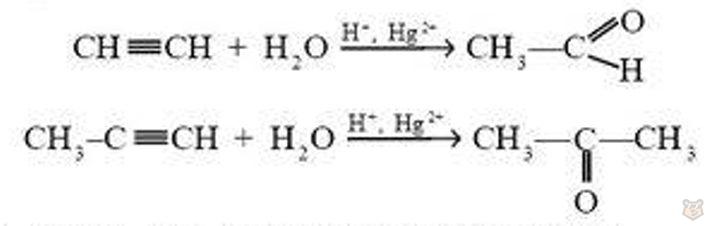
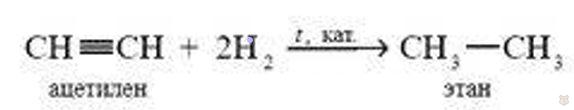
2. Галогенирование. Аналогично происходит присоединение галогенов. Например, при бромировании ацетилена вначале образуется дибромэтен, а затем тетрабромэтан:
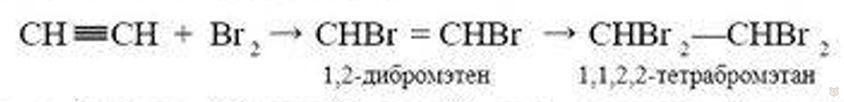
Реакция с бромом (бромной водой) для алкинов (как и для алкенов) — качественная реакция.
3. Гидрогалогенирование. Ацетилен реагирует с галогеноводородами, реакция также протекает ступенчато:
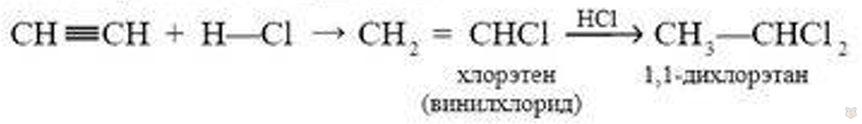
Вторая молекула хлороводорода присоединяется в соответствии правилом Марковникова.
4. Гидратация. В присутствии катализатора (сульфата ртути) ацетилен реагирует с водой. В результате образуется уксусный альдегид, а из пропина образуется ацетон (кетон):
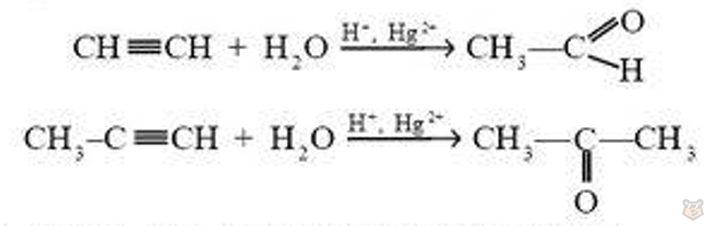
Эта реакция носит имя ученого М. Г. Кучерова.
Казахстанский ученый профессор А. Ш. Шарифканов предложил во избежание образования паров ртути проводить эту реакцию в присутствии солей трехвалентного железа. В результате реакции образуется двухвалентный катион ртути:
Hg0 + Fe3+ → Hg2+ + Fe0
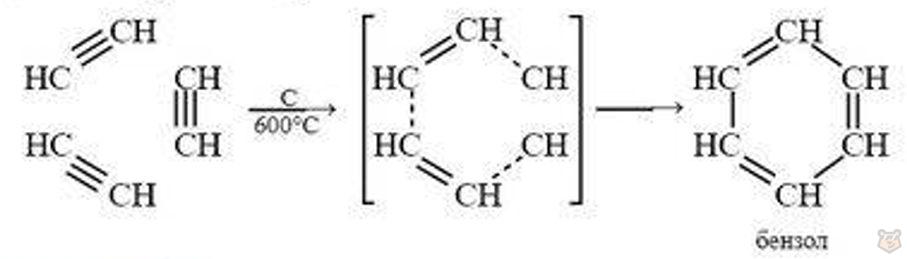
Реакции полимеризации. Ацетилен, в зависимости от условиії реакции, способен образовывать различные продукты полимеризации линейные и циклические. Наиболее важная реакция — тримеризация ацетилена, в которой получается бензол:
Реакция окисления. Ацетилен легко окисляется. Реакцию окисления можно наблюдать, если ацетилен пропустить через водный раствор перманганата калия KMnО4:
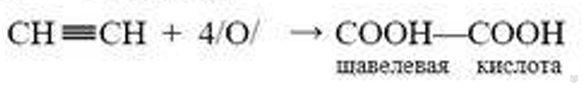
Эта реакция, как мы знаем, является качественной на кратные связи.
При полном сгорании ацетилена в воздухе образуются углекислый газ и вода, при этом развивается высокая температура около 3000°C:
2CH ≡ CH + 5О2 → 4CО2 + 2H2О + Q
При неполном сгорании ацетилена образуется углерод (сажа):
CH ≡ CH + О2 → C + CO↑ + H2О + Q
Реакции замещения. Алкины, у которых в молекуле есть концевая тройная связь (тройная связь у концевого атома углерода), вступают в реакции замещения с соединениями металла, проявляя при этом свои кислотные свойства. В результате образуются металлопроизводные ацетилена — ацетилениды . При действии на ацетилен аммначным раствором оксида серебра образуется ацетиленид серебра (осадок серого цвета):
CH ≡ CH + Ag2O → AgC ≡ CAg↓ + H2О
Эта реакция служит качественной реакцией на концевую тройную связь.
Изучением алкинов занимался выдающийся казахстанский химик Е. Н. Азербаев. Его работы внесли огромный вклад в изучение ацетиленовых углеводородов.
Применение. Ацетилен применяют в сварке и резке тугоплавких металлов. Он также используется для производства органических соединений и синтеза пластмасс, резины, красителей, лаков и других химических веществ. Ацетилен также может использоваться как источник тепла и света в промышленности и в быту.
Задания для самопроверки:
Задание 1
Пропен, бутен-1 образуются при дегидратации спиртов соответственно:
А) изопропиловый спирт и бутанол-1
В) пропанол и бутанол-2
С) пентанол-1 и гексанол-2
D) амиловый спирт и бутанол-2
E) пропиловый спирт и гексанол-1
Задание 2
Характерно для бутадиена-1,3:
А) тройная связь
В) 4 π-связи
С) sp2-гибридизация
D) 8 σ-связей
E) длина связи 0,140 нм
Задание 3
Ацетилен невозможно получить в результате реакции:
А) дегидрирование этена
В) гидролиз карбида кальция
С) дегидрирование этана
D) гидролиз карбида алюминия
E) разложение метана
Задание 4
Число изомеров положения кратной связи для алкадиена состава С5Н8:
А) 4
В) 3
С) 6
D) 8
E) 5
Задание 5
Катализатор, используемый в реакции Кучерова:
А) H3PO4
В) Al2O3
С) Ni
D) V2O5
E) HgSO4
Ответы:
1 – A, 2 – C, 3 – D, 4 – B, 5 – E.
