Основные понятия о скорости химической реакции
В данной статье мы разберем сущность скорости химической реакции. Познакомимся с понятием химической кинетики, рассмотрим гомогенные и гетерогенные химические реакции.
Как нам известно, химия изучает не только свойства и строение веществ, но и процессы превращения веществ друг в друга — химические реакции. На практике вы встречались с реакциями, которые протекают медленно, месяцами, как, например, коррозия железа.
Многие реакции в растворах (между основаниями и кислотами, между солями) проходят очень быстро, а некоторые происходят в один миг, к примеру, реакция со взрывом. Следовательно, скорость химических реакций бывает различной.
Химическая кинетика представляет собой раздел химии, который изучает скорости химических реакций. Основным понятием в ней выступает скорость реакции. В результате измерения изменения количества данных веществ за определенный промежуток времени можно определить скорость химической реакции. Также для количественной характеристики скорости реакции могут использоваться такие параметры, как изменение температуры, давления, pH, наличие катализатора и другие факторы, которые могут повлиять на скорость реакции.
Для выражения зависимости скорости реакции от различных параметров используются различные кинетические уравнения.
Изучение скорости реакций играет большую роль в понимании и оптимизации различных процессов в химическом производстве, фармацевтике, пищевой промышленности и других отраслях.
Скоростью химической реакции называют изменение концентрации реагента или продукта химической реакции во времени.
Пусть для реакции А + B = D + F концентрация вещества А в момент времени t1 равна с1, в момент времени t2 равна с2. Тогда математическое выражение для средней скорости следующее:
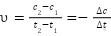
Знак «минус» ставят по следующей причине. В ходе протекания реакции (t2 — t1 > 0) концентрация вещества А убывает, следовательно, до ∆ c = (c2 — c1) < 0 будет иметь отрицательное значение, а скорость реакции имеет всегда положительное значение, поэтому перед дробью ставим знак «минус».
Скорость реакции измеряют в моль/л ⋅ с, моль/л ⋅ мин.
Существуют гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде (например, в растворе или газовой фазе).
Гетерогенными называют реакции, происходящие между веществами, которые находятся в разных фазах (например, газовой и жидкой, твердой и жидкой и др.).
Скорость гомогенной реакции определяется изменением количества одного из реагирующих веществ, вступивших в реакцию или образующихся в результате нее веществ в единицу времени в единице объема:
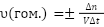
Примером гомогенной реакции может служить растворение соли в воде, так как здесь и соль, и вода находятся в жидкой фазе.
Ниже приведены уравнения некоторых гомогенных химических реакций:
N2(г) + O2(г) = 2NO(г)
N2(г) + 3H2(г) = 2NH3(г)
KOH(ж) + HNO3(ж) = KNO3(ж) + H2O(ж)
В скобках идет пояснение, в какой фазе находится данное вещество. Если вещество находится в виде газа, то обозначается буквой “г”, если в жидком состоянии — буквой “ж” либо сокращением “р-р” от слова “раствор”, в виде твердого вещества — сокращением “тв”.
Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате нее в единицу времени на единице поверхности:
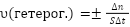
где S — площадь поверхности твердой фазы, ∆n — изменение количества вещества. В гетерогенных реакциях скорость не выражают через концентрацию, поскольку вещества реагируют не в объеме, a на поверхности.
Примером гетерогенной реакции является окисление железа воздухом, когда железо (твердый) реагирует с кислородом (газ) из воздуха.
Ниже приведены несколько примеров уравнений гетерогенных химических реакций:
СаСО3(тв) = СаО(тв) + СО2(г)
Zn(тв) + H2SO4(ж) = ZnSO4(ж) + Н2(г)
2Mg(тв) + О2(г) = 2MgО(тв)
Химическая реакция представляет собой результат столкновения частиц (атомы, молекулы, ионы) исходных веществ: чем чаще происходят такие столкновения, тем быстрее осуществляется химическая реакция.
Рассмотрим примеры решения задач на определение средней скорости химической реакции.
Пример 1. В результате разложения вещества А его концентрация за 20 минут уменьшилась от 0,14 до 0,12 моль/л. Определить среднюю скорость реакции.
Решение. Определяем среднюю скорость реакции по следующей формуле:
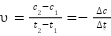
Изменение концентрации составляет: c2 — c1 = 0,12 — 0,14 = -0,02 моль/л.
Изменение времени дается в минутах, так и оставляем данное значение.
Теперь подставляем данные в формулу и определяем среднюю скорость реакции:
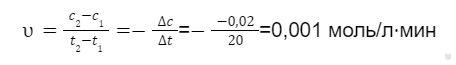
Пример 2. Рассчитать среднюю скорость химической реакции CO2 + H2 = CO + H2O, если через 80 секунд после начала реакции молярная концентрация воды была равна 0,20 моль/л, а через 2 минуты 7 секунд стала равна 0,24 моль/л.
Решение. Находим изменение концентрации во времени по той же формуле:
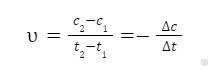
Для данной реакции изменение концентрации у воды составляет: c2 — c1 = 0,20 — 0,24 = -0,04 моль/л.
Изменение времени реакции находим по разнице конечного и начального времени, но переводим данные величины в одну единицу измерения — секунды: t2 — t1 = ((2⋅60) + 7) — 80 = (120 + 7) — 80 = 127 — 80 = 47 с.
Подставляем найденные данные в формулу и находим среднюю скорость реакции:
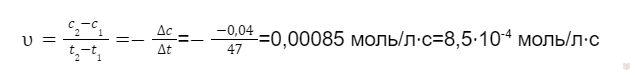
Таким образом, сделаем главные выводы касательно данной темы:
Химические реакции протекают с самыми разными скоростями.
Скорость реакции — это величина, характеризующая изменение концентрации реагентов или продуктов реакции в единицу времени.
Химическая реакция представляет собой результат столкновения частиц: чем чаще столкновения, тем быстрее осуществляется реакция.
Реакции могут быть гомогенными и гетерогенными.
Гомогенные реакции протекают в однородной среде, гетерогенные же — протекают между веществами, которые находятся в разных фазах.
Задания для самопроверки:
Задание 1
Выберите гомогенную реакцию:
А) S(тв.) + О2(г) = SO2(г)
B) СО2(г) + С(тв) = 2СО(г)
C) С2Н2(г) + 2Н2(г) = С2Н6(г)
D) Zn(тв) + HCl(ж) = ZnCl2(ж) + H2(г)
E) Al(тв) + 3CuCl2(р-р) = 3Сu(тв) + 2AlCl3(р-р)
Задание 2
Скорость гетерогенной реакции определяется выражением:
А) ![]()
B) ![]()
C) ![]()
D) ![]()
E) ![]()
Задание 3
Средняя скорость химической реакции, если изменение концентрации вещества за 30 секунд составило 1,5 моль/л:
А) 1,25 моль/л ⋅ с
B) 0,20 моль/л ⋅ с
C) 0,10 моль/л ⋅ с
D) 0,05 моль/л ⋅ с
E) 0,02 моль/л ⋅ с
Задание 4
Гетерогенная реакция представлена в уравнении:
А) N2 + O2 = 2NO
B) 3NaOH + H3PO4 = Na3PO4 + 3H2O
C) С3Н6 + Н2 = С3Н8
D) N2 + 3H2 = 2NH3
E) СaC2 + 2H2O = C2H2 + Ca(OH)2
Задание 5
Скорость гомогенной реакции можно найти по следующей формуле:
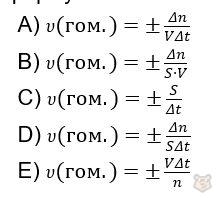
Ответы:
1 – C, 2 – B, 3 – D, 4 – E, 5 – A.

