Факторы, влияющие на смещение химического равновесия
Как нам известно, по своему направлению реакции могут быть обратимыми и необратимыми. Большинство реакций обратимы, т. е. идут в одно время во взаимно противоположных направлениях.
Обратимые реакции часто обозначают двунаправленными стрелками, чтобы показать обратимость. Данные реакции часто возникают в химических системах, где равновесие между прямой и обратной реакциями достигается при определенных условиях. Обратимость реакций является ключевым аспектом равновесия химических систем и играет важную роль в промышленности, катализе и многих других областях химии.
Примеры прямых реакций:
1. Горение метана: CH4 + 2O2 → CO2 + 2H2O
2. Реакция синтеза аммиака: N2 + 3H2 → 2NH3
3. Реакция синтеза этилена: C2H4 + H2 → C2H6
Примеры обратных реакций:
1. Обратная реакция гидролиза воды: 2H2O ⇄ 2H2 + O2
2. Обратная реакция горения углеводородов: CO2 + H2O ⇄ CH4 + 2O2
3. Обратная реакция декарбоксилирования молочной кислоты: CO2 + CH3CHOHCOOH ⇄ 2CH3CHOHCOOH
Такие условия как температура, давление, концентрация веществ влияют на направление протекания реакции.
В состоянии химического равновесия концентрации реагентов и продуктов постоянны во времени, скорость обратной реакции равна скорости прямой реакции.
Примером процесса химического равновесия является следующая реакция азота и водорода с образованием аммиака:
N2(г) + 3H2(г) ⇄ 2NH3(г)
При достижении равновесия в реакционной смеси будут присутствовать все три вещества — азот, водород и аммиак, но их концентрации будут оставаться постоянными. Количество аммиака, которое образуется за единицу времени, будет равно количеству аммиака, которое распадается на азот и водород.
Химическое равновесие играет важную роль в химических процессах, так как позволяет системе динамически реагировать на изменения условий, поддерживая оптимальное соотношение реагентов и продуктов.
Константа равновесия (Kр) для обратимой реакции выражается как отношение произведений концентраций продуктов реакции к произведению концентраций реагентов. Если Кр больше единицы, то равновесие будет смещено в сторону продуктов, а если Кр меньше единицы — в сторону реагентов.
Например, для записанной в общем виде обратимой реакции:
aА + bB ⇄ cC + dD
согласно закону действующих масс, скорости прямой (v1) и обратной (v1) реакций соответственно равны, что выражается следующим образом:
v1 = K1⋅[A]a[B]b,
v2 = K2⋅[C]c[D]d.
Концентрации реагентов и продуктов, отвечающие состоянию равновесия, называют равновесными и обозначают символами [А], [B], [C], [D]. В состоянии химического равновесия v1=v1 наблюдаем следующее:
K1⋅[A]a[B]b = K2⋅[C]c[D]d
Тогда константа равновесия равна:
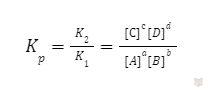
Данное уравнение является выражением закона действующих масс при химическом равновесии.
Например, выразим константу равновесия для следующей реакции синтеза HI из смеси газов — H2 и I2:
H2(г) + I2(г) = 2HI(г)
v1 = K1⋅[H2][I2],
v2 = K2⋅[HI]2,
Kp=[HI]2[H2][I2].
Если реакция гетерогенная, то в выражение константы равновесия входят концентрации лишь тех веществ, которые пребывают в газовой или жидкой фазе. Например, для реакции углекислого газа с углеродом с образованием угарного газа:
CO2(г) + C(тв) = 2СО(г)
константа равновесия имеет вид:
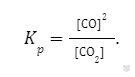
Влияние различных факторов на равновесие
Химическое равновесие при неизменных условиях может сохраняться довольно долго. Но при изменении температуры, давления или концентрации реагентов равновесие может сместиться в ту или иную сторону протекания процесса.
Направление смещения равновесия определяется по закону Ле Шателье — Брауна:
Если система находится в равновесии и подвергается изменению (изменение концентрации веществ, температуры или давления), то она будет смещаться в направлении, которое компенсирует это изменение и восстанавливает равновесие.
Рассмотрим применение данного закона к различным типам воздействия.
Влияние изменения концентрации. Если в равновесной системе увеличить концентрацию одного из реагирующих веществ, то равновесие сдвинется в сторону, где наблюдается меньшая концентрация этого вещества, т. е. в сторону образования продуктов. При уменьшении же концентрации какого-либо из реагентов, равновесие сместится в сторону образования этого же реагента, т.е. в сторону обратной реакции.
Заметим, что смещение равновесия происходит лишь при изменении концентрации реагентов, в случае же продуктов данное изменение не повлияет на смещение равновесия.
Например, при введении дополнительного количества азота равновесие реакции синтеза аммиака сместится вправо в направлении уменьшения концентрации азота и образования большего количества аммиака:
N2 + 3H2 → 2NH3
Влияние изменения давления. Если увеличить давление, то равновесие сместится в сторону уменьшения числа молекул газа (если есть газовые продукты или реагенты). Если давление уменьшить, равновесие сместится в сторону наибольшего числа молекул газа.
Разберем на примере реакции образования оксида азота (IV) из оксида азота (II) и кислорода:
2NO(г) + О2(г) ⇄ 2NO2(г)
Если повысить давление в этой системе, то равновесие сместится в сторону меньшего объема газов, т. е. вправо, в сторону прямой реакции. Суммарный объем газов в левой части уравнения равен 3 молям, а в правой части — 2 молям. Соответственно, меньший объем газов наблюдается именно в правой стороне реакции. Если понизить давление, то равновесие сместится, наоборот, в сторону обратной реакции, где имеется больший объем газов.
Влияние изменения температуры. Если повысить температуру системы, то равновесие сместится в направлении эндотермической (поглощающей теплоту) реакции, чтобы поглотить лишнюю энергию и установить новое равновесие. Если же понизить температуру, то равновесие сместится в сторону экзотермической реакции (выделяющей теплоту).
Рассмотрим реакцию синтеза того же аммиака:
N2 + 3H2 ⇄ 2NH3 + 92 кДж
Из уравнения реакции видим, что прямая реакция является экзотермической, обратная же — эндотермической.
Если увеличить температуру данной реакции, то равновесие сместится влево, при понижении же температуры будем наблюдать смещение равновесия в сторону прямой реакции.
Влияние катализаторов. Катализаторы одинаково ускоряют как прямую, так и обратную реакции, поэтому на смещение химического равновесия не влияют, а только способствуют его более быстрому образованию.
Заметим, что равновесие под влиянием изменения давления смещается лишь в том случае, когда в реакции участвуют газообразные вещества и реакция сопровождается изменением общего числа молекул.
Если общее число молекул в процессе реакции нe изменяется, то увеличение или уменьшение давления не влияет на равновесие этой реакции. Например, в реакции синтеза бромоводорода из водорода и брома:
Н2 + Br2 ⇄ 2HBr
Принцип Ле Шателье — Брауна можно применить к таким реакциям, в которых реагирующие вещества находятся в разных агрегатных состояниях. Например, в обратимой химической реакции:
CO2(г) + C(тв) ⇄ 2СО(г) — 172 кДж
повышение температуры будет смещать равновесие этой реакции в направлении эндотермического процесса — образования монооксида углерода.
Повышение давления будет смещать равновесие в направлении превращения монооксида углерода в его диоксид.
Что же касается влияния изменения концентрации компонентов на равновесие системы, то на смещении равновесия будут сказываться только концентрации газообразных веществ реакции.
Разберем несколько примеров решения задач на смещение химического равновесия.
Пример 1. Определить, куда сместится равновесие химической реакции при повышении температуры в системе:
С4H10(г) ⇄ С4H6(г) + 2H(г) – Q
Решение. При повышении температуры равновесие сместится в сторону эндотермической реакции, т. е. в сторону — Q, в направлении прямой реакции.
Пример 2. Установить, как повлияет понижение давления на равновесие в следующей реакции:
4NH3(г) + 5O2 (г) ⇄ 4NO(г) + 6H2O(г) + Q
Решение. При понижении давления равновесие сместится в сторону большего объема газов в реакции. Так как в левой части уравнения сумма объемов равна 9, а в правой — 10, делаем вывод, что направление сместится в сторону прямой реакции, вправо.
Пример 3. Определить, как повлияет уменьшение концентрации кислорода на смещение равновесия в системе:
4FеО(тв.) + О2(г) ⇄ 2Fе2О3(тв.) + Q
Решение. При уменьшении концентрации кислорода в системе равновесие сместится в сторону меньшего его количества, т. е. в сторону обратной реакции, влево.
Пример 4. Как повлияет введение катализатора на равновесие в системе:
2Н2О2(ж) ⇄ 2Н2О(ж) + О2(г)
Решение. Введение катализатора не повлияет на смещение равновесия.
Пример 5. Вычислить константу равновесия для следующей реакции:
2SO2г) + O2(г) ↔ 2SO3(г)
Равновесные концентрации равны: [SO2]=0,16 моль/л; [O2]=0,04 моль/л; [SO3]=0,08 моль/л.
Решение. Константу равновесия для данной реакции выражаем в следующем виде:
Kp=[SO3]2/([SO2]2·[O2])
Подставляем равновесные концентрации из условий задачи и находим значение Кр:
Kp=0,082/(0,162·0,04) = 6,25
Задания для самопроверки:
Задание 1
Химическое равновесие смещается в сторону образования продуктов при понижении давления в следующей реакции:
A) 2SO2 (г) + O2 (г) ⇄ 2SO3 (г)
B) 2NO2 (г) ⇄ 2NO (г) + O2 (г)
C) СО (г) + Н2О (г) ⇄ СО2 (г) + Н2 (г)
D) N2 (г) + 3H2 (г) ⇄ 2NH3 (г)
Е) 4FеО (тв) + О2 (г) ⇄ 2Fе2О3 (тв)
Задание 2
Какие из перечисленных условий повлияют на смещение равновесия в системе 4NO2 + 2H2O + O2 ⇄ 4HNO3 +Q в сторону образования азотной кислоты:
A) увеличение концентрации кислорода и понижение температуры
B) уменьшение концентрации воды и понижение температуры
C) повышение давления и уменьшение концентрации оксида азота (IV)
D) увеличение концентрации оксида азота (IV) и повышение температуры
Е) повышение концентрации кислорода и повышение температуры
Задание 3
Сместить равновесие в сторону обратной реакции в системе РСl3 (г) + Сl2 (г) ⇄ PCl5 (тв.) + Q можно в результате:
A) понижения температуры
B) добавления катализатора
C) уменьшения концентрации хлора
D) повышения давления
E) увеличения концентрации хлорида фосфора (III)
Задание 4
Вычислить константу равновесия для реакции 2NО + O2 ⇄ 2NO2, если равновесные концентрации равны [NO]=0,22 моль/л; [O2]=0,14 моль/л; [NO2]=0,12 моль/л.
A) 2,1
B) 1,8
C) 2,5
D) 0,7
E) 1,4
Задание 5
Смещению равновесия в реакции разложения карбоната кальция в сторону продуктов способствует:
A) увеличение температуры
B) повышение давления
C) понижение температуры
D) использование ингибитора
E) уменьшение концентрации карбоната кальция
Ответы:
1 – B, 2 – A, 3 – C, 4 – A, 5 – A.

