Факторы, влияющие на скорость химической реакции
На скорость химической реакции влияет множество факторов, среди которых основными являются концентрация, температура и наличие катализатора. С каждым из этих факторов мы ознакомимся подробнее.
Влияние концентрации на скорость химических реакций
При увеличении концентрации реагентов увеличивается вероятность и скорость их столкновения, что в целом приводит к ускорению реакции.
Существует взаимосвязь между концентрацией и числом частиц в системе. С повышением концентрации увеличивается число частиц вещества. Это происходит ввиду увеличения концентрации количества молекул или атомов в данном объеме.
Например, если у нас есть два раствора одного и того же вещества, но один более концентрированный, тогда во втором растворе будет больше частиц этого вещества на единицу объема, чем в первом.
Влияние концентрации реагентов на скорость химических реакций определяется законом действующих масс — главным законом химической кинетики. Этот закон утверждает, что скорость химической реакции прямо пропорциональна произведению концентраций реагентов в степени их коэффициентов в уравнении реакции.
Увеличение концентрации реагентов обычно приводит к увеличению частоты столкновений молекул, что, в свою очередь, ускоряет химическую реакцию. Однако необходимо учитывать другие факторы, такие как температура, катализаторы и т. д., которые также могут влиять на скорость реакции.
Для реакции аА + bВ = сС + dD зависимость скорости реакции от концентрации выражается соотношением:
v = k ⋅ cа(А) ⋅ cb(B)
В данном кинетическом уравнении k — коэффициент пропорциональности или константа скорости; с(A) и с(B) — молярная концентрация (моль/л) веществ А и В.
Константа скорости k показывает, как быстро происходит химическая реакция при конкретных условиях. Фактически, она представляет собой коэффициент, который показывает, насколько быстро происходит превращение реагентов в продукты реакции. Если константа скорости k большая, это означает, что реакция протекает очень быстро, а если она мала, то реакция идет медленно.
Приведенное выше выражение является кинетическим уравнением реакции. Например, для следующей реакции взаимодействия водорода с кислородом с образованием воды:
2H2 + О2 = 2Н2О
кинетическое уравнение принимает вид:
v = k ⋅ c2(Н2) ⋅ c(О2)
Для реакций, которые идут в одну стадию, показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту.
В случае сложных реакций, где участвуют несколько промежуточных стадий или реагентов, показатель степени может быть как меньше, так и больше стехиометрического коэффициента. Это связано с тем, что скорость реакции зависит не только от концентрации данного вещества, но и от других факторов, таких как активационная энергия и присутствие катализаторов. Поэтому для сложных реакций необходимо проводить эксперименты и определять показатель степени для каждого вещества отдельно.
В реакциях с последовательными стадиями определяющую роль играет самая медленная — лимитирующая. Данный принцип носит название скоростного определения реакции. Так как в лимитирующей стадии наблюдается наибольшее замедление реакции, то для увеличения суммарной скорости реакции нужно либо ускорить эту стадию, либо устранить препятствия, которые приводят к ее замедлению.
На скорость реакций с участием газов также влияет давление, потому что оно непосредственно определяет их концентрации. Так, в уравнении Менделеева-Клапейрона:
pV = nRТ
перенесем V в правую часть, а RТ — в левую, и учтем, что n/V = с, p/RT = c. Давление и молярная концентрация в законе действующих
масс прямо пропорциональны, поэтому можно подставить вместо концентрации значение р/RT. Следовательно при увеличении давления скорость реакции возрастает, а при уменьшении давления — скорость снижается. В гетерогенных реакциях учитываются лишь концентрации жидких или только газообразных реагентов, a твердые исключаются.
Делаем вывод, что закон действующих масс распространяется на газовые смеси и растворы, но не применим к реакциям с участием твердых веществ.
Столкновения между частицами веществ вызывают различные процессы, такие как образование новых химических связей, разрыв существующих связей, обмен электронами и т.д. Чтобы повысить скорость химической реакции, можно увеличить частоту столкновений частиц веществ путем увеличения их концентрации, повышения температуры, увеличения поверхности контакта или добавление катализатора.
Таким образом, частота столкновений играет важную роль в скорости химической реакции и может быть контролируемым параметром для ее ускорения.
Скорость гетерогенных реакций зависит от поверхности соприкосновения реагирующих веществ, она может быть увеличена с помощью измельчения в случае твердых веществ или путем растворения в случае для растворимых соединений.
Например, при горении угля молекулы кислорода реагируют только с теми атомами углерода, которые находятся на поверхности. При измельчении угля его поверхность возрастает, и скорость горения увеличивается. Делаем вывод, что гетерогенные реакции проходят на поверхности твердых веществ.
Скорость гомогенных реакций определяется концентрацией реагентов, так как они протекают во всем объеме системы.
Также природа реагирующих веществ оказывает влияние на скорость химических реакций. Например, реакция магния с хлороводородной кислотой идет быстрее, чем реакция железа с этой же кислотой. Это связано с тем, что магний более активный металл, чем железо, и легче реагирует с кислотой. Или к примеру ароматические соединения обычно медленнее реагируют, чем алкены или алканы. В целом неорганические вещества взаимодействуют активнее, чем органические.
Таким образом, понимание природы реагирующих веществ позволяет предсказать и контролировать скорость реакций и использовать этот фактор в различных процессах.
Решение задач на закон действующих масс.
Задача 1. Напишите кинетическое уравнение для реакции:
N2(г) + О2(г) = 2NO(г)
Решение. Для данной реакции кинетическое уравнение имеет следующее выражение:
v = k ⋅ c(N2) ⋅ c(О2)
Задача 2. Как изменится скорость реакции 2CO(тв) + О2(г) = 2СО2(г) при увеличении концентрации оксида углерода (II) в 3 раза?
Решение. 1. Кинетическое уравнение для данной реакции имеет следующий вид:
v1 = k ⋅ c2(СО) ⋅ c(О2)
2. Выразим скорость этой реакции при условии увеличения концентрации CO в 3 раза:
v2 = k ⋅ (3c)2(СО) ⋅ c(О2)
3. Выразим соотношение скоростей реакции:
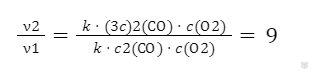
Ответ: скорость реакции увеличится в 9 раз.
Влияние температуры на скорость химических реакций.
С увеличением температуры скорость многих реакций увеличивается, так как в результате нагревания число активных частиц и частота столкновений между молекулами становится выше. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°С скорость реакции увеличивается в 2-4 раза.
Данное правило выражается соотношением:
vТ2 = vТ1 ⋅ γ(Т2-Т1)/10,
где vТ1 и vТ2 — скорости реакции соответственно при температурах Т1 и Т2;
γ — температурный коэффициент скорости реакции, определяется как отношение скорости реакции при увеличении температуры на 10 градусов к скорости реакции при исходной температуре.
Для каждой конкретной реакции температурный коэффициент определяется экспериментальным путем. Позднейшие опыты дали понять, что правило Вант-Гоффа выполнимо только для ограниченного интервала температур. При более высокой температуре возрастание скорости с ростом температуры постепенно отклоняется от этого правила.
Шведский ученый Сванте Аррениус предположил, что вступают во взаимодействие лишь частицы, имеющие избыточную энергию. Наименьшая энергия активирования частиц исходных веществ, необходимая для того, чтобы могла произойти реакция, называется энергией активации Еа (кДж/моль).
Энергию активации определяют экспериментальным путем, исследуя зависимость скорости реакции от температуры. В результате эффективного столкновения частиц образуется промежуточная группировка атомов — активированный комплекс. Эта группировка очень активна, но она существует очень короткое время, и выделить ее в индивидуальном состоянии невозможно (порядка 10-13 c).
В качестве примера рассмотрим реакцию синтеза йодоводорода:
H2 + I2 = 2HI
При столкновении молекулы водорода и молекулы йода, если они обладают достаточной энергией, образуется соответствующий комплекс H2-I2. Далее эта частица может или вернуться к исходному
состоянию, или превратиться в две молекулы йодоводорода.
Из рисунка 1 ниже видно, что образование нового вещества сопровождается выделением энергии (∆Н). Произошла экзотермическая реакция.
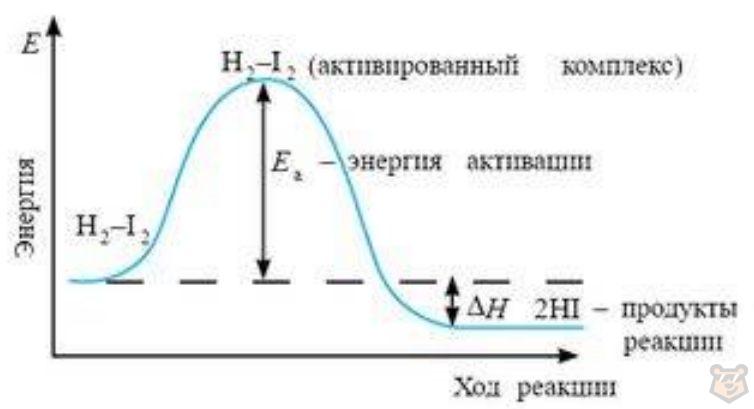
Рисунок 1 — Изменение энергии системы в ходе взаимодействия водорода и йода
Следовательно, энергия активации — это разность между значениями средней энергии активированных комплексов и средней энергией исходных молекул. Например, для реакций, требующих высокой энергии активации, может потребоваться применение специальных условий, таких как повышенная температура или использование катализаторов, чтобы ускорить процесс.
Однако стоит отметить, что энергия активации не изменяет изменение свободной энергии реакции, поэтому она не влияет на термодинамическую способность реакции протекать. Она лишь определяет скорость, с которой происходит реакция.
Энергия активации — определяющий фактор скорости реакции, который зависит от природы реагентов.
Уравнение Аррениуса описывает взаимосвязь между константой скорости k и энергией активации Еа:
k = Ае-Е/RT ,
где A — множитель, отражающий количество соударений реагентов (активных столкновений);
е — основа натуральных логарифмов;
Eа — энергия активации;
R — газовая постоянная;
T — абсолютная температура.
Число активных молекул может быть вычислено по формуле нa основе Максвелл-Больцмановского закона распределения:
NЕ = N0 ⋅ exp[-E/(RT)],
где NE — доля молекул с энергией E;
N0 — общее количество молекул в изучаемой системе;
T — температура;
\R — универсальная газовая постоянная.
Это распределение показывает, как вероятность нахождения молекулы с определенной энергией зависит от температуры.
Решение задач на тему “Правило Вант-Гоффа”
Задача 1. Некоторая реакция заканчивается при 50°С за 18 минут, а при 30°С — за 2 минуты. Определить температурный коэффициент Вант-Гоффа. Рассчитать, за какое время реакция закончится при 80°C.
Решение. Находим, во сколько раз реакция будет идти быстрее при нагревании системы от 30°С до 50°С:
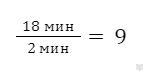
Таким образом, при нагревании системы на 20°С скорость реакции возрастает в 9 раз.
На основании уравнения Вант-Гоффа находим, что отношение скорости реакции в нагретой системе к начальной скорости реакции определяется отношением:
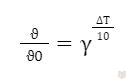
Подставляя данные, получаем уравнение и решаем его:
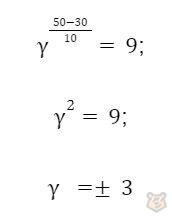
Значение -3 исключаем, оно не имеет физического смысла. Получаем, что температурный коэффициент реакции равен 3.
Возьмем за основу состояние системы, например, считаем, во сколько раз возрастет скорость реакции при 20°С. Вычислим, во сколько раз возрастет скорость реакции при нагревании системы до 80°С:
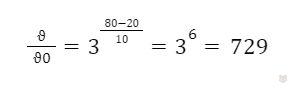
Значит, данная реакция при нагревании системы от 20°С до 80°С пойдет быстрее в 729 раз. Если она заканчивалась при 20°С за 18 минут, то при 80°С для завершения данной реакции потребуется в 729 раз меньше времени. Выразим 18 минут в секундах (1080 с) и рассчитаем время, за которое произойдет реакция при 80°С:
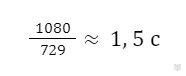
Ответ: γ = 3; реакция при 80°С закончится за 1,5 с.
Задача 2. Константа скорости распада антибиотика при температуре 36°С равна 6 ⋅ 10-6 с-1, а при 41°C равна 1,2 ⋅ 10-6 с-1. Определить температурный коэффициент скорости реакции.
Решение. Температурный коэффициент вычисляем по правилу Вант-Гоффа:
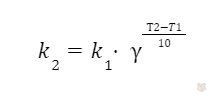
Подставляем данные:
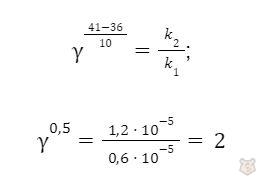
Следовательно, γ = 4.
Ответ: γ = 4.
Катализ. Один из действенных способов увеличить скорость протекания реакции — применение катализаторов — веществ, которые повышают скорость реакции, но при этом сами не расходуются в процессе.
Катализаторы ускоряют реакцию путем снижения энергии активации. Примеры катализаторов включают металлы, такие как платина, никель или железо, а также ферменты в биологических системах. Катализаторы могут значительно ускорить химические реакции, что делает их важным инструментом в производстве для получения продуктов с меньшими затратами времени и энергии.
Реакции, протекающие под действием катализаторов, называют каталитическими.
Катализом называется влияние катализаторов на скорость реакции.
В гомогенном катализе реагенты и катализатор находятся в одном агрегатном состоянии. Типичными гомогенными катализаторами являются кислоты и основания.
Например, если реакция происходит в растворе, то катализатор также должен быть в растворе, чтобы быть гомогенным. Это обеспечивает более эффективное взаимодействие между реагентами и катализатором, что повышает скорость реакции. Однако такие катализаторы обычно труднодоступны и требуют специфических условий для проведения реакции.
В гетерогенном катализе реагенты и катализатор имеют разные агрегатные состояния. В качестве гетерогенных катализаторов используются металлы, оксиды металлов и др.
Например, когда жидкий катализатор используется для ускорения реакции между газообразными или твердыми реагентами. Такой вид катализа обычно приводит к образованию границы раздела между катализатором и реагентами, что способствует более эффективному сопряжению между ними.
Примеры органических катализаторов:
1. Ферменты — белковые катализаторы, которые участвуют в биологических процессах.
2. Кислоты — сильные или слабые органические кислоты, такие как соляная кислота (HCl) или уксусная кислота (CH3COOH).
3. Основания — органические соединения, способные принимать протоны, например, аминогруппы.
4. Кетоны и альдегиды — циклические органические соединения, которые могут участвовать в катализе реакций.
Примеры неорганических катализаторов:
1. Металлы — платиновые металлы, такие как платина, палладий и родий, которые широко используются в химических промышленных процессах.
2. Оксиды металлов — оксиды металлов, такие как оксид железа (Fe2O3), которые могут использоваться в промышленности для катализа реакций окисления и превращения веществ.
3. Литий, натрий и калий — элементы из группы щелочных металлов, которые могут использоваться в качестве катализаторов в неорганических реакциях.
Простейшим примером гомогенного катализа является окисление SO2 в SO3 в присутствии NO2 с превращением последнего в H2SO4 (нитрозный метод получения серной кислоты):
SO2 + 1/2O2 + Н2О → H2SO4
Примером гетерогенного катализа служит окисление аммиака в присутствии платины:
4NH3(г) + 5O2(г) → 4NO(г) + 6H2O(г)
Механизм каталитического действия очень сложный. Для описания механизма гомогенного катализа была выдвинута теория промежуточных соединений. Суть ее состоит в том, что если медленно протекающую реакцию:
A + B → AB
вести в присутствии катализатора К, то катализатор химически взаимодействует с одним из реагентов, образуя промежуточное непрочное соединение АК:
A + К → AK
Затем это промежуточное соединение АК взаимодействует со вторым исходным веществом, катализатор в результате освобождается:
АК + В → AB + К
Если суммировать эти два процесса, получаем то же исходное уравнение:
A + B → AB
Катализ имеет широкое распространение в природе, играет огромную роль в жизнедеятельности организмов.
В нашем организме происходит непрерывное окисление углеродсодержащих веществ кислородом воздуха с образованием воды и углекислого таза. В биохимических процессах роль катализатора играют ферменты белковой природы. Следовательно, катализаторы способствуют более быстрому переходу системы из начального в конечное состояние.
Наряду с катализаторами существуют ингибиторы — вещества, замедляющие химические реакции. Они быстро вступают в реакцию с активными частицами с образованием соединений, обладающих малой активностью.
Например, ингибиторы могут использоваться в фармацевтике для уменьшения побочных эффектов лекарств или в производстве пищевых продуктов для предотвращения окисления и сохранения свежести продуктов. Также они могут применяться в промышленности для защиты оборудования от коррозии и износа.
Каталитическими ядами называют вещества, способные «отравить» катализатор, другими словами снизить его каталитическую активность или полностью прекратить каталитическое действие. Причиной является адсорбция данных веществ на поверхности катализатора.
Наиболее распространенными каталитическими ядами являются следующие соединения: H2O, CO, CO2, H2S, N2, P, As, Sb и др.
Задания для самопроверки:
Задание 1
Влияние концентрации реагирующих веществ на скорость химической реакции характеризует:
A) правило Вант-Гоффа
B) закон действующих масс
C) принцип Ле Шателье
D) закон сохранения массы
E) закон Авогадро
Задание 2
Во сколько раз изменится скорость реакции, если систему охладили с 50 °С до 10 °С, при этом температурный коэффициент равен 2:
A) уменьшится в 4 раза
B) увеличится в 12 раз
C) уменьшится в 16 раз
D) увеличится в 8 раз
Е) увеличится в 2 раза
Задание 3
Кинетическое уравнение v=k∙CA2∙CB описывает скорость реакции:
A) Cl2(г) + Cl2(г) = 2HCl(г)
B) N2(г) + 3H2(г) = 2NH3(г)
C) 2Сu(тв) + О2(г) = 2СuO(тв)
D) S(тв) + О2(г) = SО2(г)
E) 2SО2(г) + О2(г) = 2SО3(г)
Задание 4
Каталитическая реакция:
A) 4NH3 + 5O2 = 4NO + 6H2O
B) C + O2 = CO2
C) 4NH3 + 3O2 = 2N2 + 6H2O
D) 2KNO3 = 2KNO2 + O2
E) 2Li + 2H2O = 2LiOH + H2
Задание 5
Скорость реакции увеличивается в 243 раза (температурный коэффициент равен 3) при повышении температуры:
A) с 10°С до 70°С
B) с 30°С до 40°С
C) с 50°С до 80°С
D) с 30°С до 80°С
E) с 0°С до 40°С
Ответы:
1 – B, 2 – C, 3 – E, 4 – A, 5 – D.

