Закономерности изменения свойств
Химические элементы в периодической системе упорядочены по своим характеристикам, основанным на строении атома.
Д. И. Менделеев сформулировал периодический закон в 1869 году, опираясь на атомные массы элементов, так как считал их основополагающей характеристикой элемента:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомного веса элементов.
В современной интерпретации Периодический закон химических элементов звучит несколько иначе:
Свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда их атомных ядер.
То есть в основоположение взята именно характеристика заряда ядра атома, которая определяет все его свойства.
На основании этого закона и была сформирована периодическая система химических элементов. Таблица Менделеева представлена ниже на рисунке 1.
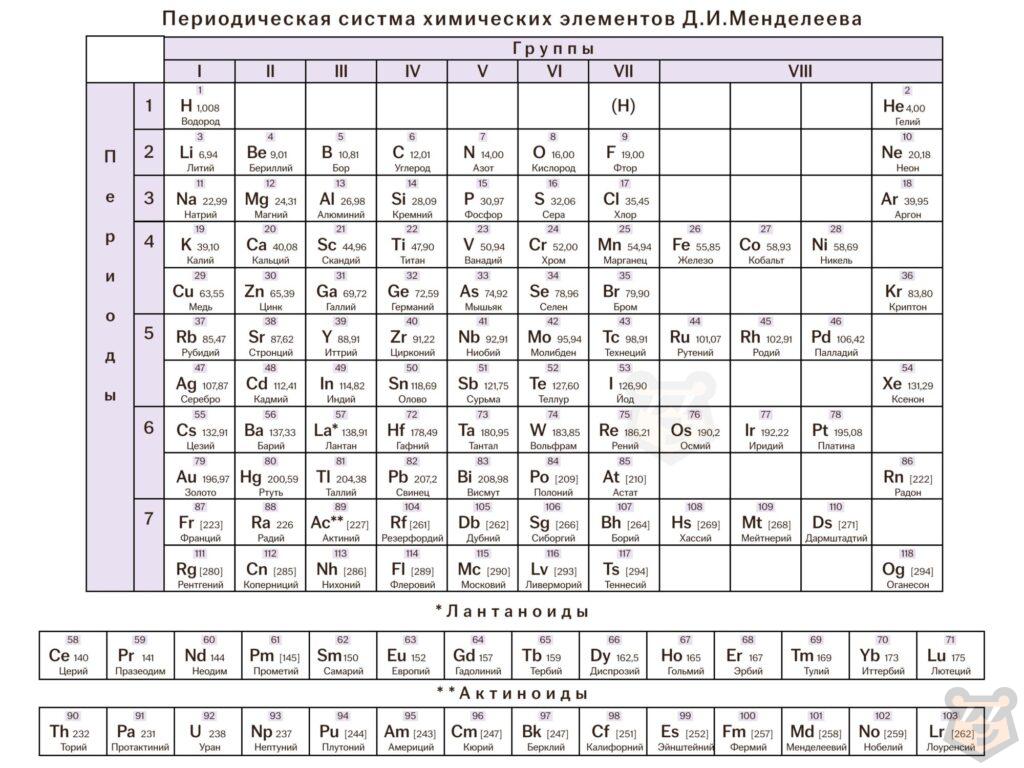
Рисунок 1 — Периодическая система химических элементов Д. И. Менделеева
Периоды — это горизонтальные ряды элементов, которые располагаются в порядке возрастания их атомных масс.
Периоды подразделяются на ряды. Ряды в свою очередь бывают четные и нечетные.
В зависимости от числа рядов периоды подразделяются на малые и большие. К малым периодам относятся периоды с 1-го по 3-й. К большим периодам относятся периоды с 4-го по 7-ой. Так, например, 7-ой период состоит из одного ряда, но он является незавершенным, так как большая часть элементов в нем получена искусственным путем. В периоде под номером 6 после элемента лантана находятся 14 элементов с порядковыми номерами 58-71. Данные элементы носят название лантаноидов. Лантаноиды размещены в таблице Менделеева отдельно внизу. Их химические свойства очень схожи друг с другом.
В седьмом периоде находятся 14 элементов с порядковыми номерами от 90 до 103, данные элементы образуют семейство под названием актиноиды. Они также вынесены отдельно в таблице — а именно под лантаноидами.
Первый период включает в себя два элемента (водород и гелий). Второй и третий периоды содержат по 8 элементов. При этом их свойства закономерно изменяются от типичного металла до благородного газа. Четвертый и пятый периоды содержат уже по 18 элементов, а шестой и седьмой периоды — по 32 элемента.
Во всех периодах с увеличением относительных атомных масс элементов (слева направо) можно наблюдать ослабление металлических свойств и усиление неметаллических свойств.
Группы — это вертикальные ряды, в которые объединены элементы, которые схожи по своим свойствам. Каждая группа состоит из двух подгрупп — главной (А) и побочной (В). Подгруппа, в которую входят элементы и малых, и больших периодов, называется главной подгруппой.
Подгруппа, в которую входят элементы только больших периодов, носит название побочной подгруппы.
Так, в главную подгруппу I группы входят такие элементы, как литий, натрий, калий, рубидий, цезий и франций — это подгруппа лития Li, под другому эту группу называют семейством щелочных металлов. Побочную подгруппу этой группы составляют такие элементы, как медь, серебро и золото — это подгруппа меди Си.
Элементы главных подгрупп образуют определенные семейства ввиду схожих химических и физических свойств. Названия естественных семейств главных подгрупп представлены ниже в таблице 1.
Таблица 1 — Названия естественных семейств главных подгрупп
| Номер группы | IA | IIA | VIA | VIIA | VIIIA |
| Название естественного семейство | щелочные металлы | щелочноземельные металлы | халькогены | галогены | благородные или инертные газы |
Химические свойства элементов главных и побочных подгрупп сильно отличаются. Например, в VII группе главную подгруппу составляют неметаллы F, CI, Br, I, At, побочную — металлы Mn, Тс, Re. Это доказывает, что подгруппы объединяют наиболее сходные между собой элементы. Элементы всех групп (кроме благородных газов) образуют кислородные соединения — оксиды. В периодической системе их часто изображают формулами, расположенными под каждой группой в порядке возрастания валентности элементов: R2O, RO, R2O3, R2O5, R2O7, RO4, где R — элемент данной группы (кроме элементов. валентность которых не совпадает с номером группы).
Высшая валентность элементов в соединениях с кислородом (за исключением некоторых элементов) соответствует номеру группы. Элементы побочных подгрупп могут проявлять и другую высшую валентность.
Так, например, медь — элемент 1 группы побочной подгруппы образует оксиды Сu2О, СuО. Однако наиболее распространенными являются соединения двухвалентной меди. В главных подгруппах (сверху вниз) с увеличением относительных атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические. B побочных подгруппах эта закономерность соблюдается не всегда.
Элементы неметаллы главных подгрупп IV-VII групп образуют летучие соединения с водородом. Их также изображают общими формулами в последовательности RH4, RH3, H2R, HR. Формулы водородных соединений расположены под элементами главных подгрупп и относятся только к ним.
Валентность элементов в соединениях с водородом определяется разностью между числом 8 и номером группы. Например, у элементов IV группы валентность равна 8-4=4, у элементов V группы: 8-5=3, у элементов VI группы: 8-6=2 и так далее.
Формулы водородных соединений некоторых элементов главных подгрупп представлены ниже в таблице 1.
Таблица 1 — Формулы гидридов некоторых элементов главных подгрупп
| I группа | II группа | III группа | IV группа | V группа | VI группа | VII группа |
| Гидрид натрия NaH | Гидрид магния MgH2 | Гидрид бора BH3 | Гидрид углерода CH4 (метан) | Гидрид фосфора PH3 (фосфин) | Гидрид серы H2S | Гидрид хлора HCl (хлороводородная или соляная кислота) |
| Гидрид калия KH | Гидрид кальция CaH2 | Гидрид алюминия AlH3 | ||||
| Гидрид лития LiH | Гидрид бериллия BeH2 |
Свойства элементов в подгруппах закономерно изменяются.
Металлические свойства наиболее сильно выражены у франция. затем — у цезия: неметаллические — у фтора, затем — у кислорода.
Закономерности изменения свойств химических элементов главных подгрупп и периодов представлены ниже в таблице 1.
Таблица 1 — Закономерности изменения свойств химических элементов главных подгрупп и периодов
| Свойство | В периодах | В главных подгруппах |
| Относительная атомная масса | возрастает слева направо | возрастает сверху вниз |
| Заряд ядра | возрастает слева направо | возрастает сверху вниз |
| Радиус атома | убывает слева направо | возрастает сверху вниз |
| Металлические | убывают слева направо | возрастают сверху вниз |
| Неметаллические | возрастают слева направо | убывают сверху вниз |
| Валентность по отношению к кислороду | возрастает слева направо | остается постоянной, равной номеру группы |
| Валентность по отношению к водороду | убывает слева направо | остается постоянной, равной8 — номер группы |
Поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. B этом заключается физический смысл периодического закона.
Периодический закон утверждает, что химические и физические свойства элементов периодически повторяются при увеличении их атомных номеров. Это происходит из-за того, что основные свойства атомов, такие как их реакционная способность, радиус ионов, электроотрицательность, и другие, определяются в основном количеством электронов на внешнем электронном уровне.
Периодический закон также описывает изменение этих свойств вдоль периодов и групп таблицы элементов. При движении вдоль периода, количество электронов на внешнем электронном слое обычно увеличивается, что влияет на химические свойства элементов. В то же время, движение вниз по группе обычно приводит к увеличению главного квантового числа, что также вносит изменения в химические свойства элементов внутри этой группы.
Таким образом, периодический закон имеет физический смысл в том, что он обусловлен строением атомов и основными принципами их взаимодействия в химических реакциях.
Обобщая все вышесказанное, сделаем главные выводы по данной теме:
Горизонтальные ряды элементов, расположенных в порядке возрастания их атомных масс, называются периодами.
Каждый период (кроме 1-го) начинается щелочным металлом и заканчивается инертным газом (кроме 7-го).
Группы — это вертикальные ряды, в которые объединены элементы, сходные по своим свойствам.
Подгруппа, в которую входят элементы и малых, и больших периодов, называется главной подгруппой.
Подгруппа, в которую входят элементы только больших периодов, называется побочной подгруппой.
Высшая валентность элементов в соединениях с кислородом (за некоторым исключением) соответствует номеру группы.
Задания для самопроверки:
Задание 1
В главных подгруппах периодической системы химических элементов Д. И. Менделеева с увеличением заряда ядра радиус атомов, как правило:
1) изменяется периодически
2) не изменяется
3) увеличивается
4) уменьшается
Задание 2
Самые сильные неметаллические свойства среди элементов 2-го периода периодической системы химических элементов Д. И. Менделеева демонстрирует:
1) углерод
2) азот
3) кислород
4) фтор
Задание 3
В периодах периодической системы химических элементов Д. И. Менделеева с увеличением заряда ядер атомов не изменяется:
1) число электронов на внешнем энергетическом уровне
2) общее число электронов
3) число энергетических уровней
4) масса атомов
Задание 4
В ряду элементов Na → Mg → Al → Si → Cl:
1) металлические свойства ослабевают
2) металлические свойства не изменяются
3) металлические свойства усиливаются
4) неметаллические свойства ослабевают
Задание 5
Самые сильные металлические свойства среди элементов IA группы периодической системы химических элементов Д. И. Менделеева демонстрирует:
1) литий
2) франций
3) калий
4) цезий
Ответы:
1 – 3, 2 – 4, 3 – 3, 4 – 1, 5 – 2.
