Строение таблицы Менделеева
Все химические элементы систематизированы в Периодической системе химических элементов Д. И. Менделеева. Она изображена ниже на рисунке 1.
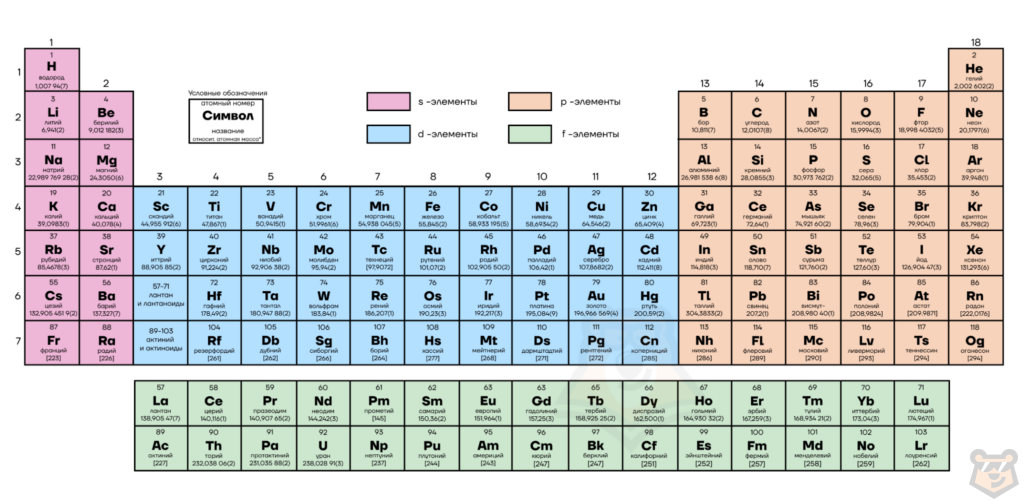
Из таблицы Менделеева можно узнать относительные атомные массы химических элементов. По порядковому номеру можно определить заряды атомных ядер и равное им число протонов и электронов. Число нейтронов находится по разнице между значением относительной атомной массы и порядкового номера элемента.
Электронная оболочка атома образована слоями. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют энергетический уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Исходя из принципа распределения электронов по энергетическим уровням атомов можно сделать следующие выводы:
— у элементов 1-го периода (водород и гелий) — 1 энергетический уровень;
— у элементов 2-го периода (от лития до неона) — 2 энергетических уровня:
— у элементов 3-го периода (от натрия до аргона) — 3 энергетических уровня:
— у элементов 4-го периода (от калия до криптона) — 4 энергетических уровня и т. д.
Номер периода показывает число энергетических уровней.
Далее посмотрим, как распределяются электроны на последнем уровне для элементов трупп (пока только главных подгрупп). Можно сделать следующие выводы:
— у элементов 1-й группы главной подгруппы (от лития до калия) 1 электрон на внешнем уровне;
— у элементов 2-й группы главной подгруппы (от бериллия до кальция) — 2 электрона на последнем уровне;
— у элементов 6-й группы главной подгруппы (от кислорода до селена) — 6 электронов на внешнем уровне и т. д.
Номер группы (для главных подгрупп) показывает число электронов на последнем уровне.
Таким образом, каждая цифра в периодической системе имеет определенный определенный смысл.
Периодическая система — графическое выражение периодического закона. В зависимости от способа объединения элементов в Группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода. Число элементов в периодах следующее: 2, 8, 8, 18, 18, 32. 32.
Все периоды, кроме первого, начинаются с щелочного металла (Li, Na, К и т. д.) и заканчиваются благородным газом (He, Ne, Ar, Кr и т. д.).
В короткопериодной таблице восемь групп, каждая из которых делится на 2 подгруппы (главную и побочную), в длиннопериодной таблице 18 групп, которые нумеруются римскими цифрами с буквами А или В. Например: IA, IIIB, VA, VIIB. Группа А длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодный таблицы: группа VIIB — побочной подгруппе седьмой группы; остальные — аналогично.
Таким образом, можно сделать следующие основные выводы по данной теме:
Атомный номер элемента совпадает с величиной заряда ядра и равен числу протонов и электронов.
Число нейтронов находят, отняв от атомной массы число протонов.
Номер периода показывает число энергетических уровней.
Номер труппы для главных подгрупп показывает число электронов на внешнем уровне.
Задания для самопроверки:
Задание 1
Укажите порядковый номер для элемента фтора:
А) 7
В) 9
С) 19
D) 16
E) 20
Задание 2
Номер периода элемента алюминия :
А) 1
В) 2
C) 3
D) 4
E) 5
Задание 3
Номер группы элемента серы:
А) II
В) III
C) V
D) VI
E) VII
Задание 4
Какой элемент имеет 4 энергетических уровня:
А) кальций
В) фосфор
C) углерод
D) натрий
E) йод
Задание 5
Определите элемент, расположенный в 5-м периоде, группе VIA:
А) кремний
В) сурьма
C) теллур
D) бор
E) олово
Ответы:
1 – B, 2 – C, 3 – D, 4 – A, 5 – C.
