Квантовые числа
В этой статье мы познакомимся с характеристиками и принимаемыми значениями квантовых чисел, рассмотрим закономерности и правила заполнения электронных орбиталей.
Квантовые числа описывают состояние всех электронов в атоме. Ими являются: главное (n), орбитальное (l), магнитное (m) и спиновое (ms) квантовые числа.
Рассмотрим их подробнее.
Главное квантовое число (n) идентифицирует энергетический уровень электрона и размер его атомной орбитали. Оно может принимать целые значения, например, 1, 2, 3 и т. д.
В атоме энергетические уровни обозначают буквами, начиная с буквы K и продолжая далее по алфавиту. Каждая буква обозначает подуровень электронов в атоме. Таким образом, самые низкие уровни обозначаются буквой К, затем следуют буквы L, M, N, O, P, Q и так далее.
Каждому значению n соответствует число орбиталей, равное n2. Например, если n = 1, то число орбиталей будет равно 12 = 1. Если n = 2, то число орбиталей будет равно 22 = 4. Если же n = 3, то число орбиталей будет равно 32 = 9. И дальше по такому же принципу.
По данным из таблицы 1 можно проследить тесную взаимосвязь главного квантового числа n с другими параметрами электронов.
Таблица 1 — Взаимосвязь главного квантового числа с другими параметрами электронов
| Энергетический уровень (n) | Число подуровней, равное n | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в подуровне, равном n2 | на подуровне | на подуровне, равном 2n2 | |||
| К (n=1) | 1 | 1s | 1 | 1 | 2 | 2 |
L (n=2) | 2 | 2s | 1 | 4 | 2 | 8 |
| 2p | 3 | 6 | ||||
M (n=3) | 3 | 3s | 1 | 9 | 2 | 18 |
| 3p | 3 | 6 | ||||
| 3d | 5 | 10 | ||||
N (n=4) | 4 | 4s | 1 | 16 | 2 | 32 |
| 4p | 3 | 6 | ||||
| 4d | 5 | 10 | ||||
| 4f | 7 | 14 | ||||
Так, исходя из значений в таблице 1, можно установить следующие связи:
1. С увеличением главного квантового числа n увеличивается количество подуровней на энергетическом уровне.
2. Тип подуровня (s, p, d, f) определяется значением азимутального квантового числа l, которое зависит от значения главного квантового числа n.
3. Количество орбиталей на подуровне равно 2*l + 1, где l — азимутальное квантовое число, соответственно с увеличением n увеличивается и количество орбиталей.
4. Максимальное количество электронов на подуровне определяется по правилу двух n2. Таким образом, если увеличивается n, возрастает максимальное число электронов на энергетических подуровнях и уровнях.
Орбитальное (азимутальное, побочное) квантовое число (l) характеризует форму атомной орбитали и имеет определенные значения в зависимости от главного квантового числа n:
l = 0, 1, … (n-1)
К примеру, если n = 2, то l = 0, 1; если n = 3, то l = 0, 1, 2. Число l характеризует подуровень (подслой).
Совокупность электронов, имеющих одинаковое орбитальное квантовое число l, носит название энергетического подуровня. Каждому значению l соответствует определенный энергетический подуровень, а также определенная орбитальная форма.
Орбитальное квантовое число может принимать следующие значения: l = 0, 1, 2, 3.
Энергетический подуровень обозначается буквами: s, p, d, f.
Точное число подуровней зависит от главного квантового числа n. Для каждого значения n существует 2n + 1 подуровней. Например, для n = 1 будет 3 подуровня (1s, 2s, 2p), для n = 2 будет 5 подуровней (2s, 2p, 3s, 3p, 3d) и так далее.
Число энергетических подуровней в уровне не должно быть больше главного квантового числа n. Так, если n=2, то число энергетических подуровней в этом уровне не должно превышать двух. Таким образом, в уровне с n=2 может быть один подуровень s и один подуровень p, но не может быть трех или более подуровней
Распределение электронов по уровням и подуровням представлено в виде схемы на рисунке 1.
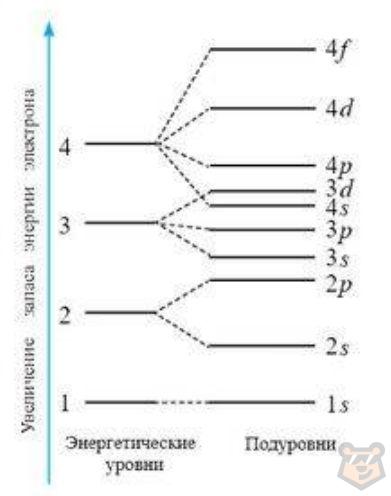
Рисунок 1 — Схема энергетических уровней и подуровней в атоме
В таблице 2 представлены обозначения подуровней, соответствующие главному и орбитальному квантовым числам.
Таблица 2 — Обозначения подуровней, соответветствующие главному и орбитальному квантовым числам
| Значения n | Значения l | Обозначения подуровней |
| 1 | 0 | 1s |
| 2 | 0, 1 | 2s, 2p |
| 3 | 0, 1, 2 | 3s, 3p, 3d |
| 4 | 0, 1, 2, 3 | 4s, 4p, 4d, 4f |
При l = 0 (s-подуровень) электронное облако имеет сферическую форму, показанную на рисунке 2.
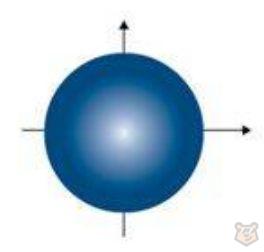
Рисунок 2 — Форма s орбитали
При l = 1 (р-подуровень) орбиталь имеет форму гантели, что продемонстрировано на рисунке 3.
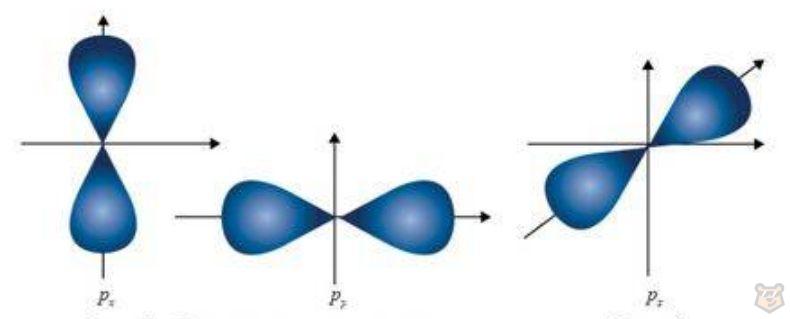
Рисунок 3 — Ориентация в пространстве рх, рy, рz
Орбитали d обладают формой, напоминающей чашеобразное углубление, в то время как орбитали f обладают еще более запутанной формой, напоминающей сложные трехмерные фигуры. Эти орбитали характерны для атомов с большим числом электронов, таких как переходные металлы и элементы блока f. Они играют важную роль в химических свойствах элементов. Данные орбитали проиллюстрированы на рисунках 4 и 5.
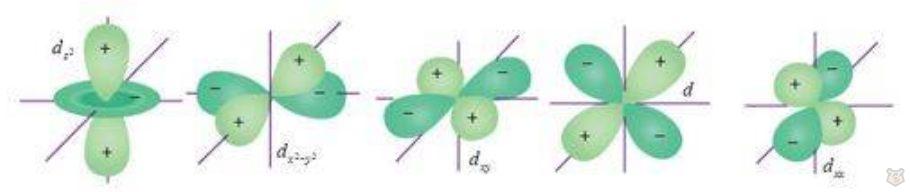
Рисунок 4 — Возможные формы d-орбиталей
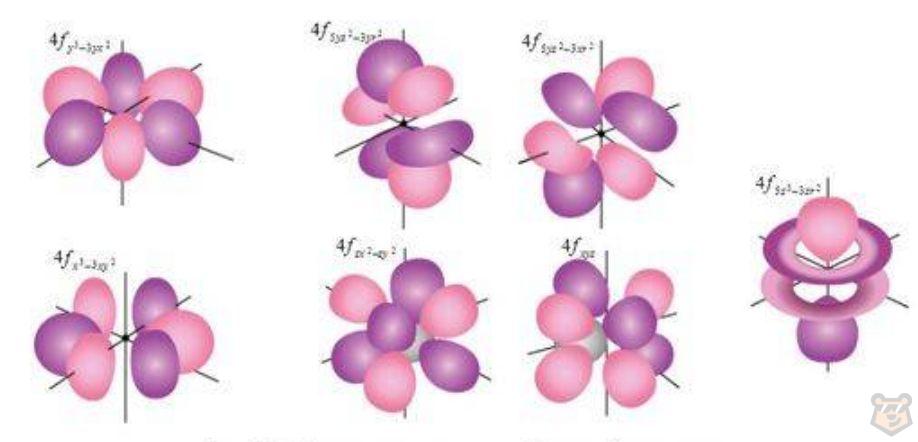
Рисунок 5 — Формы электронных облаков f-электронов
Количество орбиталей на подуровне определяется магнитным квантовым числом (m). Магнитное квантовое число показывает pacпределение орбиталей в магнитном поле ядра, оно зависимо от орбитального квантового числа и принимает значения от 0 до l — 1; m = 2l + 1.
Пример: при l = 0, m = 0 — орбиталь одна; при l = 1, m = -1, 0, 1 — три орбитали. Отметим, что все орбитали имеют симметричное пространственное расположение.
При l = 2; m = -2, -1, 0, 1, 2 — пять орбиталей. Следовательно, эти пять d-орбиталей ориентированы по пяти разным направлениям.
При l = 3; m = -3, -2, -1, 0, 1, 2, 3 — семь орбиталей. Семь различных f-орбиталей обладают более усложненной формой. Число ориентаций таких орбиталей равно семи.
Число орбиталей с определенным значением l представлено в таблице 3.
Таблица 3 — Число орбиталей с определенным значением l
| Значения l | Значения m | Число орбиталей с заданным значением l | Условное обозначение орбиталей |
| 0 (s) | 0 | 1 | |
| 1 (p) | -1, 0, +1 | 3 | |
| 2 (d) | -2, -1, 0, +1, +2 | 5 | |
| 3 (f) | -3, -2, -1, 0, +1, +2, +3 | 7 |
Движение электрона вокруг своей оси называют спином, оно представлено на рисунке 6. Спин электрона является одним из его важнейших свойств и имеет квантовый характер. Он имеет определенные значения, которые обычно обозначаются стрелками «вверх» и «вниз».
Спин электрона играет ключевую роль в магнитных свойствах вещества, таких как ферромагнетизм и антиферромагнетизм. Квантовая механика позволяет предсказывать результаты измерения спина электрона и его взаимодействия с другими частицами.
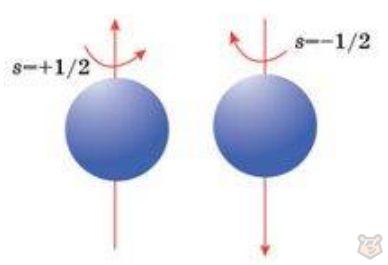
Рисунок 6 — Спин электрона
Спиновое квантовое число s и его проекция ms. Спиновое квантовое число s имеет всегда одно значение 1/2, а его проекция характеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против). Принимает два значения: +1/2 (имеет обозначение в виде стрелки, направленной вверх) и -1/2 (имеет обозначение в виде стрелки, направленной вниз).
Таким образом, квантовые числа n, l, m, s (и вспомогательное ms) в полной мере определяют энергетическое состояние, количество орбиталей, формы электронов и их расположение в пространстве.
Переход электрона из одного энергетического уровня на другой осуществляется в ходе поглощения или испускания фотона — элементарной частицы света, данный процесс называют атомным спектром.
При переходе между состояниями меняются квантовые числа, что в свою очередь приводит к изменению энергии атома. Когда атом поглощает квант энергии, происходит переход электрона на более высокий энергетический уровень. При испускании же кванта энергии, осуществляется переход электрона на более низкий уровень. Излученный фотон имеет энергию, соответствующую разнице энергий между уровнями.
Таким образом, атомный спектр позволяет изучать энергетическую структуру атомов и молекул, а также определять их состав и свойства.
В таблице 4 собрана итоговая информация о квантовых числах и их значениях.
Таблица 4 — Квантовые числа и их значения
| Символ состояния | Значения квантовых чисел | Символ состояния | Значения квантовых чисел | ||||||
| n | l | ml | ms | n | l | ml | ms | ||
| 1s | 1 | 0 | 0 | ±1/2 | 3p | 3 | 1 | 1 | ±1/2 |
| 2s | 2 | 0 | 0 | ±1/2 | 3p | 3 | 1 | -1 | ±1/2 |
| 2p | 2 | 1 | 0 | ±1/2 | 3d | 3 | 2 | 0 | ±1/2 |
| 2p | 2 | 1 | 1 | ±1/2 | 3d | 3 | 2 | 1 | ±1/2 |
| 2p | 2 | 1 | -1 | ±1/2 | 3d | 3 | 2 | -1 | ±1/2 |
| 3s | 3 | 0 | 0 | ±1/2 | 3d | 3 | 2 | 2 | ±1/2 |
| 3p | 3 | 1 | 0 | ±1/2 | 3d | 3 | 2 | -2 | ±1/2 |
Существуют определенные правила заполнения энергетических уровней и подуровней для атомов в их основном состоянии. Разберем подробнее эти правила.
Принцип (запрет) Паули. Этот принцип гласит о том, что в каждом электронном уровне могут находиться не более двух электронов, причем они имеют разные спины.
Правило Гунда (Хунда). В пределах подуровня электроны сначала заполняют свободные орбитали (по одному) и лишь после этого образуют электронные пары, что показано на рисунке 7. Это определяет устойчивое состояние атома.
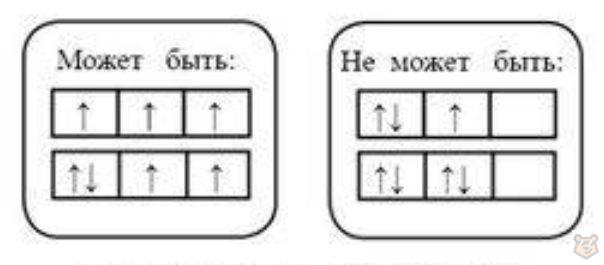
Рисунок 7 — Правило Гунда (Хунда) заполнения орбиталей
Следовательно, если орбитали имеют одинаковую энергию, в каждую из них сначала поступает по одному электрону. Такое расположение позволяет электронам в атоме находиться как можно дальше друг от друга. Как только на каждой орбитали будут находиться по одному электрону, в них начнут появляться вторые электроны — произойдет спаривание.
Правило Клечковского. Данное правило говорит о том, что электроны в основном состоянии заполняют орбитали в последовательности повышения орбитальных энергетических уровней. Низшие по энергии орбитали всегда заполняются первыми. Энергия орбиталей возрастает в ряду, представленном схематично на рисунке 8 ниже:

Рисунок 8 — Энергия орбиталей
Данная последовательность выражается диаграммой, проиллюстрированной на рисунке 9.
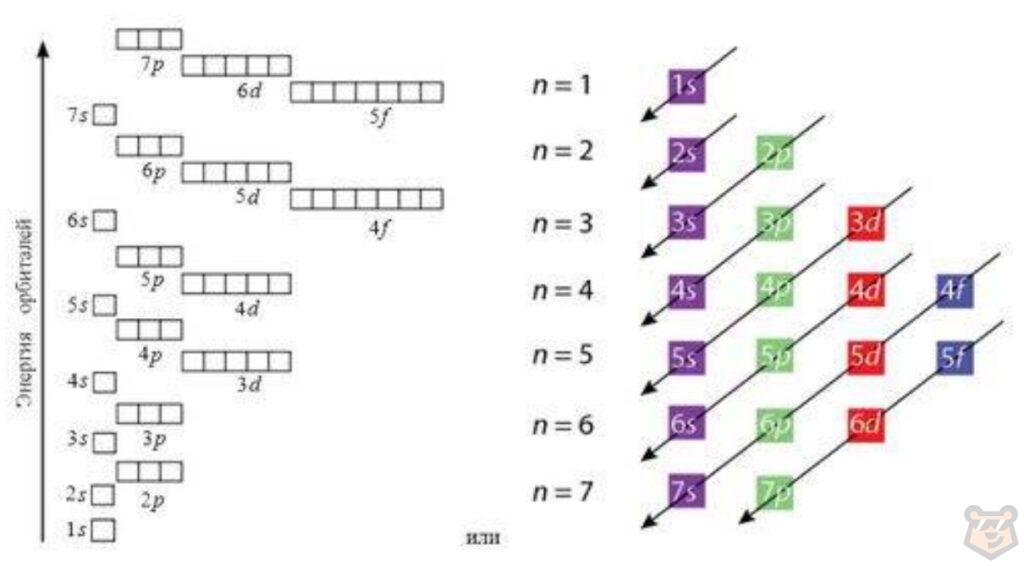
Рисунок 9 — Энергетическая диаграмма
Электронные конфигурации атомов элементов. Ввиду того, что в химических реакциях ядра атомов не претерпевают изменения, соответственно химические свойства атомов зависят от строения электронных оболочек.
Распределение электронов в слоях и орбиталях именуется электронной конфигурацией атома. Есть разные способы представления распределения электронов в атоме:
— в виде электронных схем 11Na 2b, 8b, 1b и диаграммы Бора, представленной на рисунке 10;
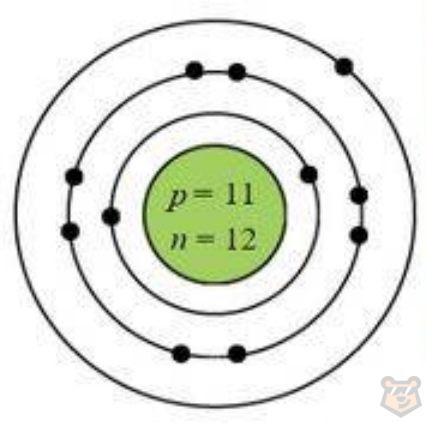
Рисунок 10 — Диаграмма Бора
— в виде электронных конфигураций:
11Na 1s22s22p23s1;
— в виде электронно-графических схем, пример представлен ниже на рисунке 11:
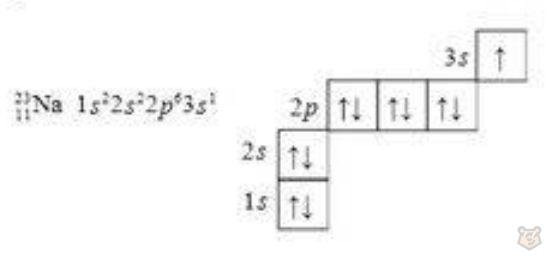
Рисунок 11 — Электронно-графическая схема атома натрия
— в сокращенном виде, так как в атомах элементов каждого периода повторяется конфигурация атома, например: [Ne]3s1.
Рассмотрим примеры применения квантовых чисел.
Задача 1. Составьте электронно-графическую форму внешнего
электронного уровня атома фосфора. Какой набор всех квантовых чисел соответствует этому состоянию фосфора?
Решение. Элемент фосфор находится в третьем периоде и в VA (15) группе Периодической системы Д. И. Менделеева. Следовательно, на внешнем 3-м уровне данного атома находятся пять электронов. Pacпределим эти электроны по атомным орбиталям:
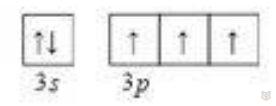
Внешним пяти электронам атома фосфора будет отвечать следующий набор квантовых чисел, представленный в таблице 5:
Таблица 5 — Набор квантовых чисел внешних пяти электронов атома фосфора
| Номер электрона | 1 | 2 | 3 | 4 | 5 |
| n | 3 | 3 | 3 | 3 | 3 |
| l | 0 | 0 | 1 | 1 | 1 |
| ml | 0 | 0 | -1 | 0 | +1 |
| ms | +1/2 | +1/2 | +1/2 | +1/2 | +1/2 |
Задача 2. У элементов каких периодов электроны внешнего уровня характеризуются значением n + l = 4?
Решение. Определим возможные комбинации n u l:
Если n = 1, то l может быть только 0, значит, n + 1 = 1. Данный вариант не подходит.
Если n = 2, то l может быть только 0 и 1, значит, n + l = 2 + 0 = 2, или n + 1 = 2 + 1 = 3. Тоже не подходит.
Если n = 3, то l может быть только 0, 1 и 2, значит: n + 1 = 3 + 0 = 3. Данный вариант не подходит. Или n + l = 3 + 1 = 4. Этот вариант подходит. Или n + l = 3 + 2 = 5. Вариант не подходит.
Значит, это могут быть р-элементы 3-го периода, например, сера и хлор.
Если n = 4, то 7 может быть только 0, 1, 2 и 3, значит:
n + l = 4 + 0 = 0. Подходит. Или n + 1 = 4 + 1 = 5. Не подходит. Или n + l = 4 + 2 = 6. Не подходит. Или n + l = 4 + 3 = 7. Не подходит.
Следовательно, это могут быть s-элементы 4-го периода калий и кальций.
Задания для самопроверки:
Задание 1
Количество орбиталей на подуровне определяет это квантовое число:
А) спиновое
В) магнитное
С) вспомогательное
D) главное
E) азимутальное
Задание 2
Орбитальное квантовое число не может принимать следующее значение:
А) 3
В) 2
С) 4
D) 0
Е) 1
Задание 3
Размер атомной орбитали и энергетический уровень электрона характеризует данное квантовое число:
А) спиновое
В) магнитное
С) вспомогательное
D) главное
E) азимутальное
Задание 4
Квантовое число, характеризующее два возможных направления вращения электрона вокруг своей оси:
А) спиновое
В) магнитное
С) вспомогательное
D) главное
E) азимутальное
Задание 5
При орбитальном квантовом числе, равным 1, орбиталь приобретает форму:
А) сферы
В) тетраэдра
С) спирали
D) гантели
E) глобулы
Ответы:
1 – B, 2 – C, 3 – D, 4 – A, 5 – D.

