Кристаллические решетки
Известно, что все вещества в обычных условиях бывают в трех агрегатных состояниях: твердом, жидком и газообразном. Возникает вопрос: как отражается на физических свойствах определенного вещества природа химических связей в нем? Попытаемся найти ответ на эти вопросы.
При затвердевании веществ образующие их частицы располагаются в определенном порядке.
Твердые вещества могут быть разделены на два основных типа по их молекулярной структуре и физическим свойствам: аморфные и кристаллические. Разберем каждый тип подробнее.
1. Аморфные вещества. Их молекулы расположены без определенного порядка или регулярной структуры. Это означает, что они не имеют длинного диапазона упорядоченности, как в кристаллических веществах. Примеры аморфных веществ включают стекло, пластик и некоторые полимеры.
2. Кристаллические вещества. В отличие от аморфных, кристаллические вещества имеют регулярную, повторяющуюся структуру, которая простирается на большие расстояния. Внутри кристаллической структуры атомы или молекулы упорядочены в определенном порядке, формируя кристаллическую решетку. Это придает им определенные физические свойства, такие как определенная точка плавления и кристаллическая форма. Примеры таких кристаллических веществ включают соль, лед и алмаз.
Выбор между аморфными и кристаллическими структурами может существенно влиять на свойства материалов, такие как прозрачность, твердость, пластичность и теплопроводность.
Правильное расположение частиц в кристаллах называется кристаллической решеткой.
Места, где находятся частицы, образуют узлы кристаллической решетки.
Выделяют следующие типы кристаллических решеток в зависимости от того, какие частицы образуют узлы этой решетки:
- атомная:
- молекулярная;
- ионная:
- металлическая.
Рассмотрим каждый тип по отдельности.
Ионные кристаллические решетки. Такие решетки являются характерными структурами для ионных соединений. Они образуются за счет взаимного притяжения противоположно заряженных ионов. Например, в узлах кристаллической решетки хлорида натрия NaCI находятся ионы натрия Na+ и хлорид-ионы Сl— Данная кристаллическая решетка проиллюстрирована на рисунке 1 ниже.
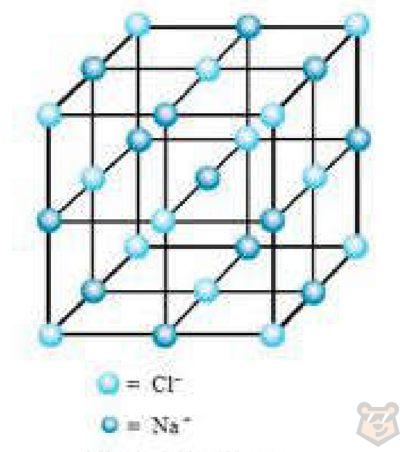
Рисунок 1 — Кристаллическая решетка хлорида натрия
Когда ионы различных зарядов соединяются в кристаллической решетке, они формируют устойчивую трехмерную структуру.
В ионной решетке каждый ион окружен ионами противоположного заряда, образуя так называемую «октаэдрическую» или «тетраэдрическую» координационную сферу. Это обеспечивает стабильность кристаллической структуры за счет кулоновского притяжения между ионами с противоположными зарядами.
Примеры ионных соединений включают хлориды, оксиды, нитриды и сульфиды, где отрицательно заряженные частицы (анионы) и положительно заряженные частицы (катионы) образуют кристаллические решетки с различной степенью сложности и симметрии.
Атомные кристаллические решетки. Данные тип кристаллических решеток представляет упорядоченное расположение атомов в кристаллической структуре. Каждый узел решетки при этом содержит атом, который связан с соседними атомами с помощью ковалентных связей. Это обеспечивает прочность и устойчивость кристалла.
Атомные кристаллические решетки встречаются в таких простых веществах, как графит, алмаз, кремний, бор и т. д. Можно заметить, что обычный речной песок состоит преимущественно из оксида кремния (SiO2), а его структура представляет собой атомную кристаллическую решетку. Каждый атом кремния соединен с двумя атомами кислорода ковалентными связями.
Что касается кристалла алмаза, то его структура представляет собой трехмерную решетку, в которой каждый атом углерода связан с четырьмя другими атомами углерода ковалентными связями. Это придает алмазу высокую твердость и прочность. На рисунке 2 под буквой а представлена кристаллическая решетка алмаза.
Графит — это одна из форм аллотропии углерода, в которой атомы углерода организованы в плоские слои, которые могут сдвигаться относительно друг друга. Каждый слой графита состоит из атомов углерода, связанных в плоской кристаллической решетке сильными ковалентными связями. Однако слои между собой связаны слабыми взаимодействиями ван-дер-Ваальса, что делает графит мягким и позволяет слоям сдвигаться друг относительно друга. Это обеспечивает графиту его уникальные свойства, такие как мягкость, проводимость тепла и электричества. Кристаллическая решетка графита показана на рисунке 2 под буквой б.
Как видим, различие между алмазом и графитом заключается в формах кристаллических решеток. Поэтому они отличаются по своим свойствам. Например, твердость алмаза превышает твердость всех веществ. Графит же легко расщепляется на чешуйки, именно это его свойства используется при изготовлении карандашных грифелей.
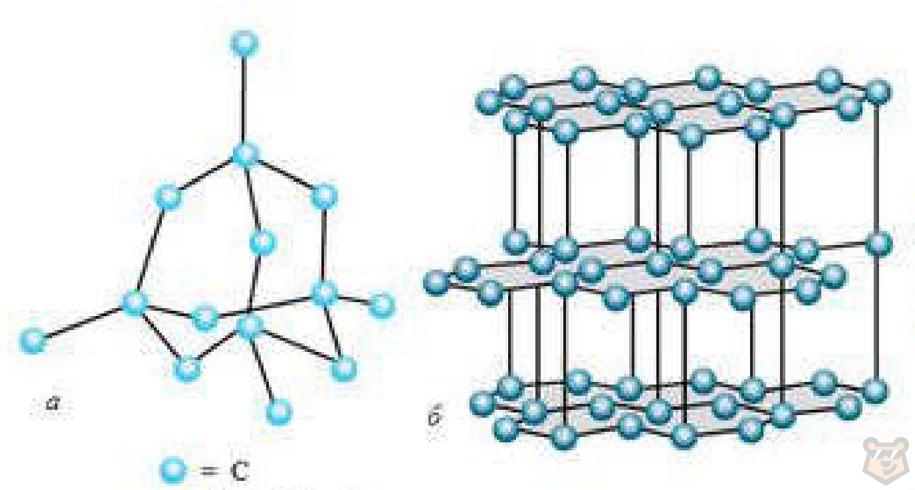
Рисунок 2 — Кристаллическая решетка алмаза (а) и графита (б)
Молекулярные кристаллические решетки. Молекулярные кристаллические решетки могут состоять из неполярных или полярных молекул. В неполярных кристаллах молекулы обычно располагаются таким образом, чтобы их дипольные моменты компенсировали друг друга, что делает кристалл неполярным в целом. Примерами неполярных кристаллических решеток являются кристаллы инертных газов, таких как аргон или кристаллы многих органических соединений.
С другой стороны, в полярных кристаллах молекулы имеют дипольные моменты, которые не компенсируются друг другом. В результате кристалл в целом обладает полярностью. Примерами полярных кристаллических решеток являются некоторые минералы, такие как кварц, и многие органические соединения, включая нитраты и сульфаты. В узлах кристаллических решеток имеются неполярные или полярные молекулы. Можно привести пример в качестве вещества с молекулярной кристаллической решеткой лед. Его кристаллическая решетка представлена на рисунке 3. Как можно заметить, в узлах имеются полярные молекулы воды. А к примеру, в узлах кристаллической решетки кислорода (при температуре ниже -219 °С) находятся неполярные молекулы O2. Следовательно, молекулярные кристаллические решетки — это решетки, узлы которых содержат как полярные, так и неполярные молекулы.
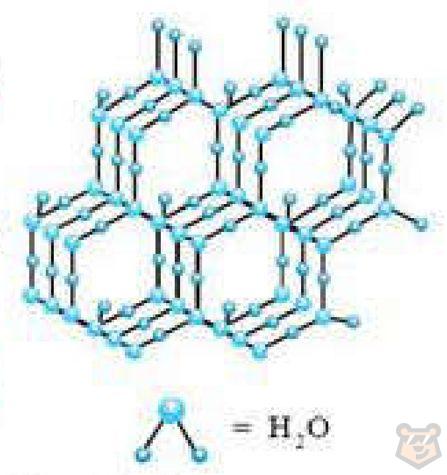
Рисунок 3 — Кристаллическая решетка льда
Металлическая кристаллическая решетка. В таких решетках положительно заряженные ионы (обычно металлические атомы) располагаются в узлах решетки, образуя кристаллическую структуру. Между этими ионами находятся свободные или делящиеся электроны, которые могут свободно двигаться по всей структуре.
Металлическую кристаллическую решетку имеют все металлы (Na, Ca, Fe, Al, Cu и другие, кроме ртути) и сплавы. Особое строение таких решеток обуславливает их общие физические свойства. Именно это делает металлы отличными проводниками электричества и тепла. На рисунке 4 ниже представлена кристаллическая решетка меди Cu.
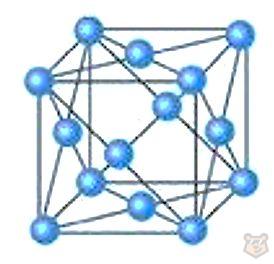
Рисунок 4 — Кристаллическая решетка меди
Зависимость свойств веществ от типа кристаллической решетки. Существует одна из основных концепций в химии и материаловедении, известная как принцип корреляции строения и свойств вещества. Этот принцип подтверждает, что свойства вещества в значительной степени определяются его атомным или молекулярным строением, а также взаимодействиями между его составляющими частями.
На практике, анализируя строение вещества, можно предсказать его физические и химические свойства. Например, зная атомную структуру материала, можно предсказать его прочность, электрическую проводимость, теплопроводность и другие характеристики.
С другой стороны, изучая свойства вещества, можно делать выводы о его строении и характере внутренних связей между атомами или молекулами.
Пользуясь этой закономерностью, попытаемся предсказать температуры плавления фторида натрия NaF, фтора F2, и фторида водорода НF.
Узлы кристаллической решетки фторида натрия образуются катионами натрия Na+ и фторид-анионами F—. Связи между ними достаточно сильны. Поэтому и температура плавления данного вещества должна быть достаточно высокой, чтобы разрушить его кристаллическую структуру. Кроме того, следует отметить, что определенные вещества с ионным типом кристаллической решетки имеют достаточно большое значение твердости и обладают хорошей растворимостью в воде. Водные растворы и расплавы этих веществ также хорошо проводят электрический ток.
В узлах кристаллической решетки у фтора имеются неполярные
молекулы F2. Ввиду того, что силы сцепления между ними небольшие, фтор имеют низкую температуру плавления.
У фтороводорода в узлах кристаллической решетки имеются уже полярные молекулы. Здесь можно наблюдать большую силу сцепления между полярными молекулами по сравнению с предыдущими неполярными молекулами фтора. Из всего этого делаем вывод, что фтороводород обладает более низкой температурой плавления нежели фторид натрия, но более высокой по сравнению со фтором. Подтверждающие это предположение данные представлены в таблице 1.
Таблица 1 — Температура плавления некоторых веществ
| Название вещества | Химическая формула | Температура плавления, ℃ |
| Фторид натрия | NaF | 905 |
| Фтороводород | HF | -83 |
| Фтор | F2 | -220 |
Следует отметить, что вещества с молекулярной решеткой имеют низкие температуры плавления и кипения, высокую летучесть, малую твердость. К веществам с молекулярными кристаллическими решетками относятся инертные газы, углекислый газ СО2, вода, галогены, сера, галогеноводороды и др.
Ковалентные связи между атомами очень прочные. Поэтому можно предположить, что для веществ с атомной кристаллической решеткой характерна высокая температура плавления и большая прочность. Например, оксид кремния SiO2, является нелетучим и тугоплавким соединением.
Таким образом, можно заключить, что свойства веществ во многом определяются их кристаллической структурой.
Задания для самопроверки:
Задание 1
Не относится к типу кристаллической решетки:
А) молекулярная
В) ионная
С) аморфная
D) металлическая
E) атомная
Задание 2
Тип кристаллической решетки, в которой частицы, находящиеся в ее узлах, связаны между собой общими электронными парами:
A) атомная
B) молекулярная
C) ионная
D) аморфная
E) металлическая
Задание 3
Тип кристаллической решетки в H2O:
A) атомная
B) молекулярная
C) ионная
D) аморфная
E) металлическая
Задание 4
Ионная кристаллическая решетка в веществе:
A) HCl
B) CO2
C) CaO
D) Si
E) N2
Задание 5
Тип кристаллической решетки в речном песке:
A) молекулярная
B) аморфная
C) металлическая
D) атомная
E) ионная
Ответы:
1 – C, 2 – A, 3 – B, 4 – C, 5 – D.

