Энергетические уровни
Для описания поведения микроскопических объектов необходимо использовать квантовую механику, которая описывает взаимодействие элементарных частиц на микроуровне. В этой теории объекты могут проявлять свойства как волны, так и частицы, их состояние определяется вероятностно, а не детерминированно.
Микроскопические объекты действуют в соответствии с новыми, непривычными законами, которые были разработаны специально для описания мира на микроуровне. Именно поэтому поведение таких объектов и частиц не всегда соответствует нашему привычному пониманию законов макромира.
Квантовая механика является базовой наукой для описания поведения микромира и играет ключевую роль в современной науке.
Изучение поведения электронов в атоме позволяет понять структуру и свойства вещества, а также использовать эти знания в различных областях науки и техники, от химии и физики до электроники и квантовых технологий.
Познакомимся ближе с микромиром, изучив характер поведения электронов в атоме.
Точное местоположение электрона в атоме не может быть определено в определенный момент времени из-за его волнового характера. Вместо этого, электроны пребывают в областях вероятности, называемых орбиталями, представляющими разнообразные энергетические состояния электронов. Следовательно, состояние электрона в атоме определяется его энергией и вероятностным распределением в пространстве.
Электрон представляют частицу, находящуюся в постоянном движении вокруг ядра, и волну — облако, не имеющее траектории и четких внешних границ.
Наиболее наглядно представление об электронном облаке можно получить на основании такого мысленного эксперимента. Предположим, мы в состоянии получить очень большое число фотографий положения электрона в атоме водорода в различные моменты времени. Наложив эти фотографии друг на друга, мы как раз и получим трехмерную картину электронного облака, представленную на рисунке 1. И там, где число точек наибольшее, облако наиболее плотное. Максимальная плотность электронной оболочки атома соответствует самой вероятной области пребывания электрона в данном атоме. Это понятие непосредственно взаимосвязано с распределением электронов по энергетическим уровням и формированием электронной конфигурации атома.

Рисунок 1 — Электронное облако как набор моментальных “фотографий” электрона:
а) вид со стороны; б) вид в сечении
Рисунок 2 описывает вероятность пребывания электрона в некоторой области трехмерного околоядерного пространства с координатами x, y, z.
Часть атомного пространства, имеющая наибольшую вероятность нахождения в ней электрона (равна приблизительно 90 %), именуется атомной орбиталью.
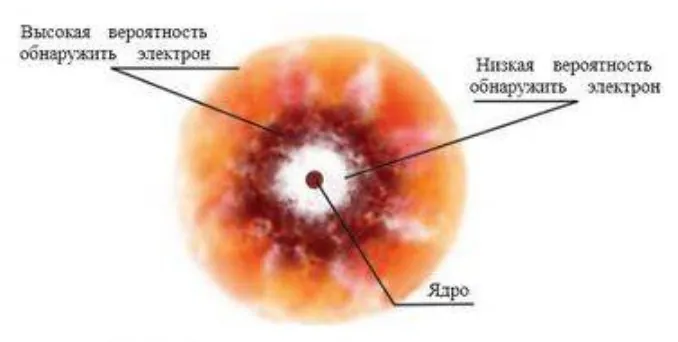
Рисунок 2 — Вероятность пребывания электрона
Состояние каждого электрона в атоме можно описать четырьмя квантовыми числами: главным (n), орбитальным (l), магнитным (m) и спиновым(ms).
Главное квантовое число (n) является первым и самым важным из четырех квантовых чисел в модели атома Бора. Оно определяет основной энергетический уровень электрона и размер его орбитали. Чем больше значение n, тем выше энергетический уровень электрона и больше его орбиталь.
Главное квантовое число является ключевым параметром в описании электронной структуры атома и играет важную роль в определении его свойств и химического поведения.
Энергетические уровни обозначают буквами K, L, M, N, О, P, Q и т. д., которым соответствуют значения n = 1, n = 2, n = 3, n = 4 и т. д.
Совокупность электронов с одинаковым значением главного квантового числа (n) называется энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n = 1). С увеличением главного квантового числа наблюдается возрастание энергии электрона.
Чисто энергетических уровней в атоме численно равно номеру периода, в котором находится элемент.
Исходя из вышесказанного, можно определить, что у атомов элементов первого периода на одном энергетическом уровне располагается один электрон, у элементов второго периода – два электрона, у элементов третьего периода – три электрона и так далее. Количество электронов на каждом энергетическом уровне увеличивается на один с каждым последующим периодом. Это правило наблюдается в соответствии с распределением электронов по энергетическим уровням в атоме и связано с тем, что атомы стремятся заполнить свои энергетические уровни электронами до достижения наиболее стабильного состояния.
Максимальное число электронов на данном энергетическом уровне определяется следующим уравнением:
N = 2n2 ,
где N — число электронов на данном энергетическом уровне;
n — номер энергетического уровня (номер периода, главное квантовое число).
Следовательно, на первом, втором, третьем и четвертом энергетических уровнях могут находиться соответственно не более 2, 8, 18, 32 электронов.
Рассмотрим, как распределяются электроны в соответствии с энергетическими уровнями в атомах первых двадцати химических элементов, начиная с первого из них — водорода. Для этого воспользуемся периодической системой.
Один электрон водорода и два электрона гелия движутся на первом энергетическом уровне. В первом, ближайшем к ядру, электронном слое может находиться не более двух электронов.
Следовательно, первый энергетический уровень заполнен максимально при наличии на нем двух электронов (2 ⋅ 12 = 2); второй — при наличии восьми электронов (2 ⋅ 22 = 8); третий — восемнадцати (2 ⋅ 23 = 18) и т. д.
В атоме водорода (H) электрон находится на единственном энергетическом уровне — первом. В атоме гелия (He) два электрона распределены на первом энергетическом уровне. Таким образом, в обоих случаях энергетический уровень заполнен полностью. Данное распределение показано на рисунке 3 ниже.
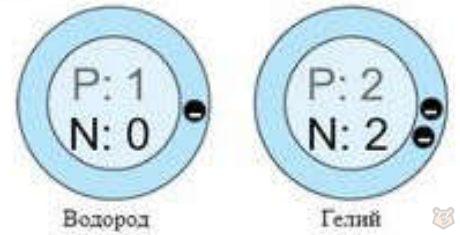
Рисунок 3 — Электроны атомов водорода и гелия
У атомов лития третий электрон помещается на втором энергетическом уровне, так как первый уже заполнен, что проиллюстрировано на рисунке 4.
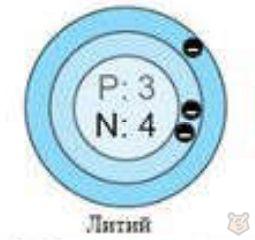
Рисунок 4 — Электроны атома лития
Всего на втором энергетическом уровне могут поместиться восемь электронов (у неона), поэтому во 2-м периоде имеется восемь элементов.
За неоном следует натрий, у которого прибавляется еще один электрон. Поскольку два первых слоя заполнены, то последующий электрон натрия располагается на третьем электронном слое. За натрием следуют элементы, у которых заполняется третий электронный слой в том же порядке, что и у элементов предыдущего периода. Третий энергетический уровень заполняется от натрия до аргона, что представлено на рисунке 5.
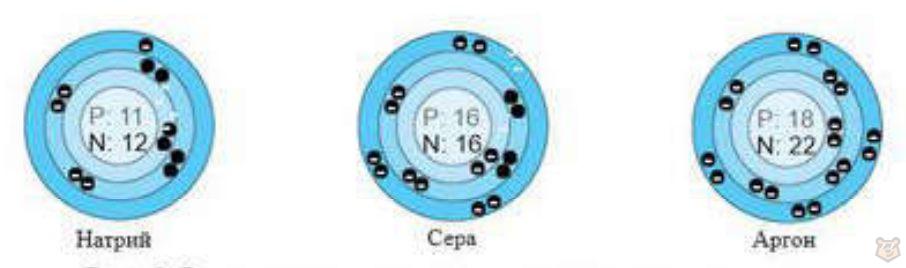
Рисунок 5 — Расположение электронов натрия, серы и аргона
Подобно неону у атома аргона на третьем электронном слое движется восемь электронов. Дальнейшее заполнение электронами третьего энергетического уровня на этом прекращается.
Из приведенных схем видно, что Н и Не заполняют 1-й период периодической системы, элементы от Li до Ne — 2-й период, элементы от Na до Аr — 3-й период.
Отсюда вытекает следующее правило: число энергетических уровней (слоев) совпадает с номером периода, в котором находится элемент.
В одном периоде объединяются элементы с одинаковым числом энергетических уровней в атоме.
Атом химического элемента, стоящего в начале периода и относящегося к первой группе, имеет один внешний электрон при заполненных внутренних слоях. Атомы элементов второй группы имеют два электрона на внешнем слое и т. д.
Элементы с аналогичным строением оболочки внешней оболочки объединяются в единую группу. Номер группы (в главной подгруппе) показывает число электронов на последнем уровне.
Например, в качестве главной подгруппы можно рассмотреть элементы периодической системы химических элементов. Так, в первой группе элементов (щелочные металлы) номер группы показывает количество валентных электронов (например, литий имеет один электрон на последнем уровне, натрий — два).
Также важно отметить, что внешний энергетический уровень может содержать не больше восьми электронов, тогда он именуется завершенным (у инертных газов). Электронные слои без максимального числа электронов являются незавершенными.
Можно сделать вывод о том, что одинаковое строение внешних энергетических уровней элементов периодически повторяется, в связи с чем идет повторение свойств элементов. Эта закономерность отражена в названии «Периодическая система химических элементов Д. И. Менделеева».
Каждый химический элемент имеет определенное количество электронных оболочек, содержащих определенное число электронов. Валентные электроны, или электроны внешнего энергетического уровня, играют решающую роль в проявлении химических свойствах элементов. Поэтому элементы с одинаковым строением этих внешних энергетических уровней обладают схожими химическими свойствами. Это обуславливает возможность группировать элементы в периодической системе Менделеева и предсказывать свойства новых элементов на основе уже известных.
Обобщая вышесказанное, сделаем главные выводы по данной теме:
Электроны в атомах элементов распределяются по энергетическим уровням (слоям).
Энергетические уровни бывают завершенными (состояние инертного газа) и незавершенными.
В одной группе расположены элементы со сходным строением внешнего уровня.
Номер группы (для элементов главных подгрупп) указывает на число электронов, находящихся на последнем уровне.
Задания для самопроверки:
Задание 1
Энергетический уровень — это совокупность электронов с одинаковым значением:
А) главного квантового числа
B) орбитального квантового числа
C) магнитного квантового числа
D) спинового квантового числа
E) вспомогательного квантового числа
Задание 2
Число энергетических уровней в атоме Si:
А) 1
B) 2
C) 3
D) 6
E) 7
Задание 3
Завершенный энергетический уровень имеет следующий атом:
А) Sr
B) H
C) Pb
D) As
E) Xe
Задание 4
Количество энергетических уровней равно 5 у следующего элемента:
А) алюминий
B) бор
C) фосфор
D) йод
E) ртуть
Задание 5
Число электронов на последнем энергетическом уровне равно 3 у следующего элемента:
А) P
B) Ga
C) Cr
D) Ag
E) Te
Ответы:
1 – A, 2 – C, 3 – E, 4 – D, 5 – B.

