Химическая связь
В данной статье мы ознакомимся с понятием химической связи и рассмотрим механизмы образования всех типов химической связи.
Что же представляет из себя химическая связь?
Химическая связь — это электростатическое взаимодействие, объединяющее отдельные атомы в сложные системы.
Химическая связь образуется из-за взаимодействия электронов во внешних оболочках атомов. Существует несколько типов химических связей. К ним относятся ковалентная, ионная, металлическая и водородная связи. Каждый тип связи имеет свои особенности и характеристики, определяющие свойства вещества.
Разберем каждый тип химической связи подробно.
Ковалентная связь — это связь, которая образуется благодаря общим электронным парам.
Ковалентная связь формируется между атомами, когда они делят один или несколько электронов, чтобы образовать общую оболочку валентных электронов. Эта связь довольно прочная и обеспечивает стабильность молекулы или иона. Водород, кислород, азот и углерод — атомы, образующие ковалентные связи, являются основными компонентами органических соединений: белков, ДНК, глюкозы, жиров и других важных веществ в природе.
Ковалентная связь имеет два механизма образования. К ним относятся обменный и донорно-акцепторный механизмы. Подробно они показаны в таблице 1 ниже.
Таблица 1 — Механизмы образования ковалентной связи
| Обменный | Донорно-акцепторный |
| Обменный механизм начинает действовать в тот момент, когда атомы объединяются в результате формирования общих электронных пар:A↑ + ↓B = A↑↓B | При установлении связи с использованием данного механизма один атом играет роль донора электронов, а другой выступает в качестве акцептора. Акцептор обеспечивает наличие свободной орбитали. Ковалентная связь образуется за счет перехода уже существующей электроннойпары в общее использование донора и акцептора:А + ↑↓Д = А↑↓Д |
1) Н2 — водород: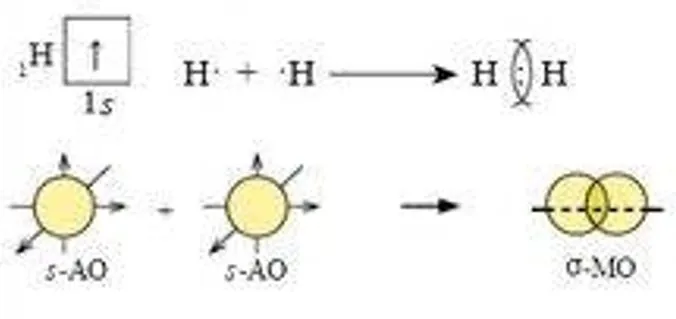 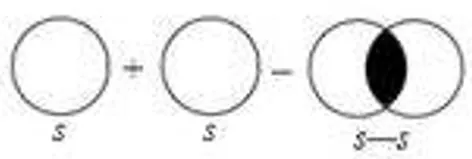 2) НCl — хлороводород: 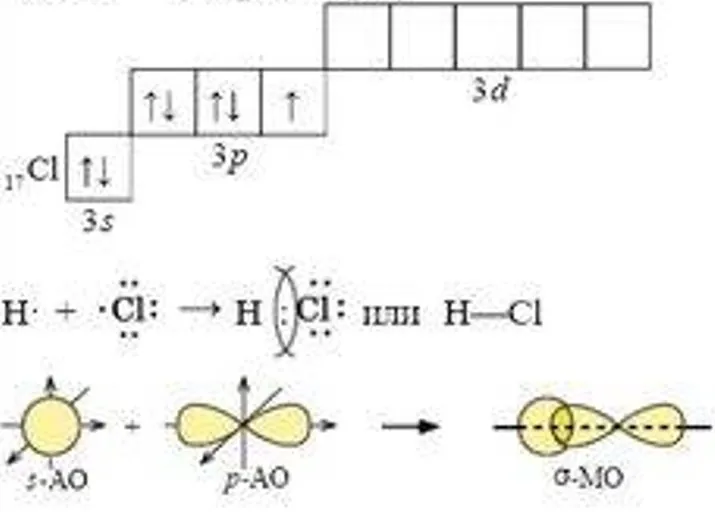 3) В молекуле хлора химическая связь формируется за счет одиночных p-электронов, которые взаимодействуют через перекрытие p-орбиталей: 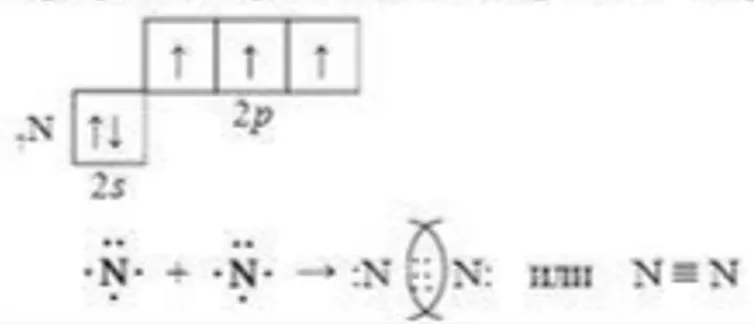 | В процессе образования катиона аммония (NH4+), аммиак (NH3) приобретает дополнительный протон (H+). В NH3 азот имеет неподеленную пару электронов, поэтому он играет роль донора. Таким способом формируется катион аммония с одной неподеленной парой электронов и положительным зарядом.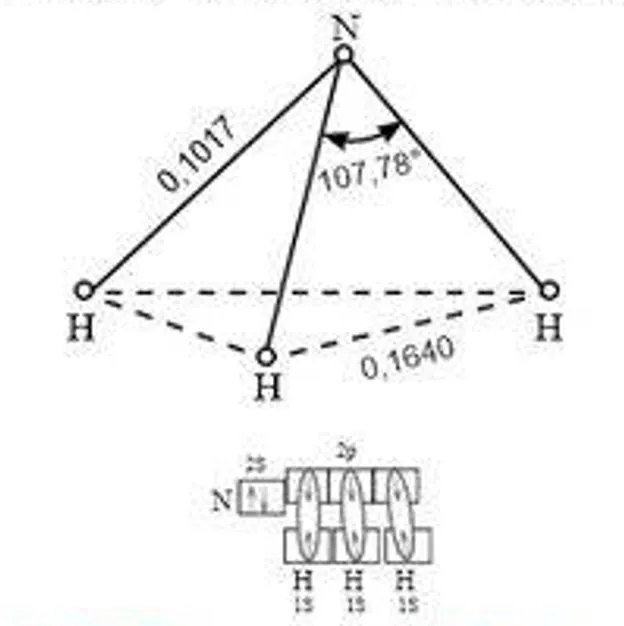 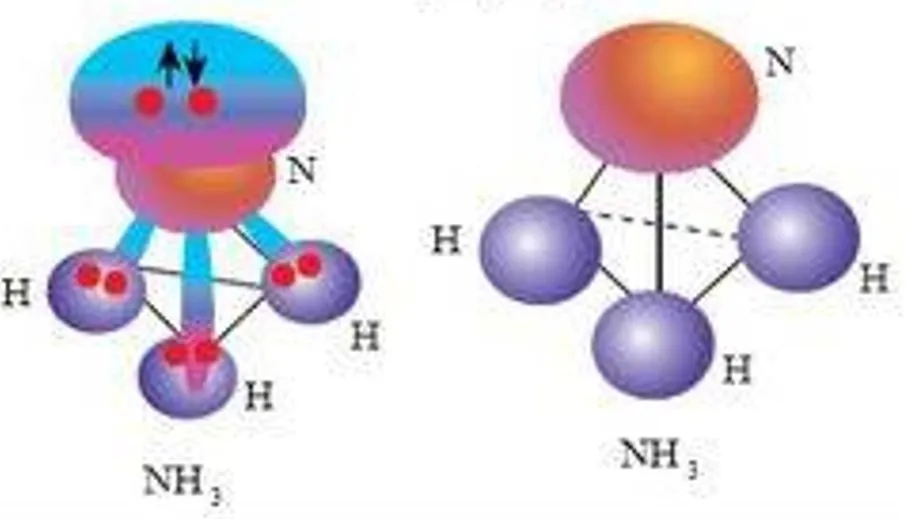 У катиона водорода имеется свободная орбиталь, ввиду чего он является акцептором.  В результате ион аммония NH4+ имеет четыре ковалентные связи: три образованы обменным механизмом, одна — донорно-акцепторным. Несмотря на это, все связи равноценны. |
Ковалентная связь бывает полярной и неполярной.
В качестве примера неполярной ковалентной связи рассмотрим молекулу хлора:
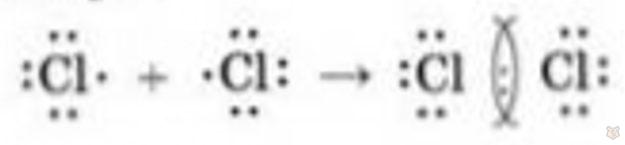
Молекула Cl2 образуется из двух атомов хлора, каждый из которых имеет в составе семь валентных электронов. При образовании молекулы Cl2 каждый атом хлора делит один из своих валентных электронов с другим атомом, при этом формируется неполярная ковалентная связь. В результате оба атома хлора достигают восьми валентных электронов, что является наиболее стабильным состоянием для них.
Ковалентная неполярная связь образуется между атомами неметаллов, которые имеют одинаковую электроотрицательность.
В такой связи электроны в одинаковой степени разделяются между атомами, что обеспечивает их стабильность.
Примерами простых веществ-неметаллов, образованными ковалентной неполярной связью, служат молекулы H2 (водород), N2 (азот), O2 (кислород), F2 (фтор), Cl2 (хлор) и др.
В каждой такой молекуле, атомы неметаллов соединены ковалентными неполярными связями и образуют стабильную структуру. Такие молекулы обладают свойствами, связанными с химической активностью элементов и их взаимодействием с другими соединениями.
Механизм образования полярной ковалентной связи можно рассмотреть на примере хлористого водорода НСІ. За счет объединения неспаренных электронов хлора и водорода образуется молекула хлористого водорода. Возникающая при этом обобществленная электронная пара будет смещена к более электроотрицательному хлору:
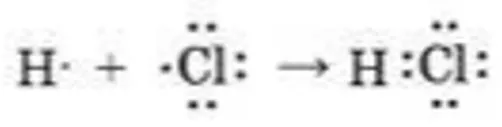
В той части молекулы, где имеется более электроотрицательный элемент (ЭО CI (3,12), накапливается избыток отрицательного заряда (CIδ-), а где менее электроотрицательный элемент (ЭО Н (2,1) — избыток положительного заряда (Нδ+). Данные молекулы носят название полярных.
Химическая связь, образованная атомами, электроотрицательность которых отличается незначительно, называется ковалентной полярной связью. Такая связь образуется за счет обменного механизма.
Например, связи в диоксиде углерода СО2 полярные, но молекула при этом не является полярной ввиду линейного строения, которое представлено ниже на рисунке 1 под буквой а.
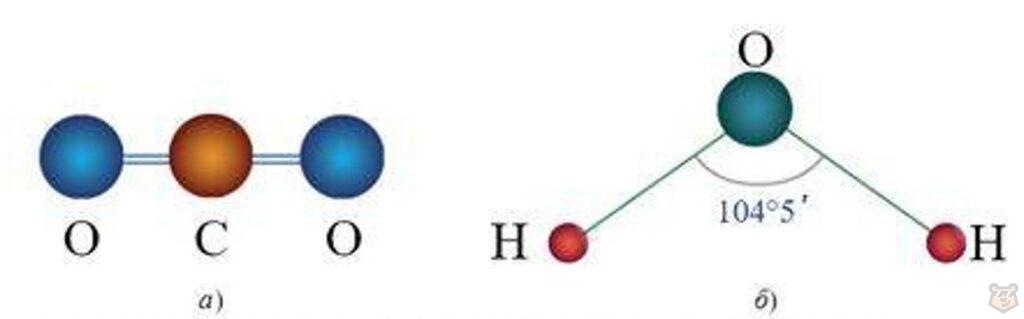
Рисунок 1 — Формы молекулы: а) линейная СО2; б) угловая H2O
Молекула H2O имеет полярную связь, так как атомы водорода и кислорода имеют различные значения электроотрицательности. Однако благодаря углу водородных атомов касательно атома кислорода молекула имеет дипольный момент и является полярной, что показано на рисунке 1 выше под буквой б. Поэтому полярность молекулы зависит не только от полярности связей, но и от их геометрии.
Валентный угол НОН составляет 104°5’, у атома кислорода с частичным отрицательным зарядом ઠ— и двумя неподеленными электронными парами формируется отрицательный полюс молекулы, а у атомов водорода с зарядом ઠ+ — положительный.
Диполь молекулы воды представлен на рисунке 2 ниже.
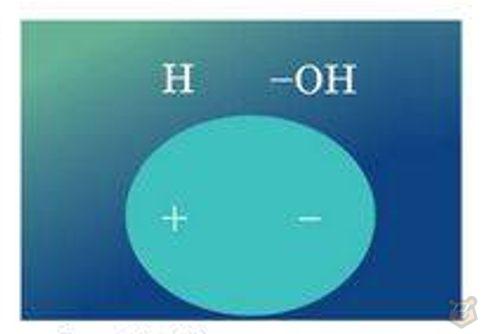
Рисунок 2 — Диполь молекулы воды
Гомолитический и гетеролитический разрыв ковалентной связи. При гомолитическом разрыве образуются два свободных радикала, каждый из которых содержит непарный электрон:
A : B ⟶ A་ + ་B
Этот тип разрыва более характерен для сильных и стабильных неполярных или слабополярных связей, таких как C-C или C-H.
При гетеролитическом разрыве один атом получает оба электрона из общей пары, а другой остается без электронов, образуя положительный ион:
A : B ⟶ A+ + :B—
Этот процесс обычно происходит в присутствии электрофильного или нуклеофильного агента, который приводит к положительному или отрицательному заряду на атомах после разрыва связи. Также данный тип разрыва более характерен для полярных связей, в которых один атом имеет большую электронную плотность по сравнению с другим, таких как C-O или C-Cl.
Таким образом, гомолитический разрыв обычно происходит в неполярных и слабополярных связях, в то время как гетеролитический разрыв характерен для полярных связей.
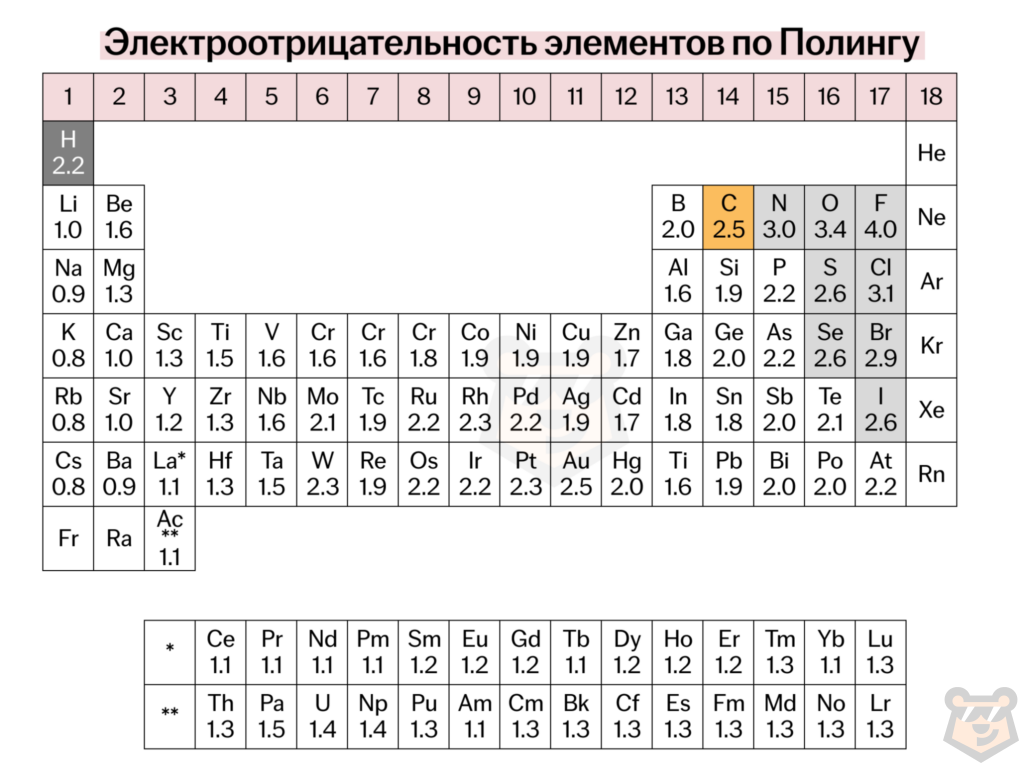
Электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны атомов других элементов. Электроотрицательность элементов последовательно возрастает слева направо в каждом периоде, и имеет наибольшее значение у галогенов, а наименьшее — у щелочных металлов.
В пределах каждой группы, за несколькими исключениями, электроотрицательность последовательно убывает сверху вниз, следовательно, металлические свойства возрастают.
При этом наиболее полярной будет связь между металлом и неметаллом, так как у неметаллов выше значения электроотрицательности.
Электроотрицательность химических элементов по Полингу представлена ниже в таблице 2.
Таблица 2 — Электроотрицательность химических элементов по Полингу
Ионная связь. Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (∆ЭО > 1,7), то общая электронная плотность переходит к атому с большей ЭО. В результате образуются электрически заряженные частицы. Такие частицы носят название ионов:
A∙ + ∙B → A+ + [:B—]
Между образовавшимися ионами образуется электростатическое притяжение, называемое ионной связью. Ионная связь возникает между атомами, когда один атом теряет электрон(ы) и становится положительно заряженным ионом (катионом), а другой атом принимает эти электроны и становится отрицательно заряженным ионом (анионом). Так эти ионы и образуют в результате электростатического притяжения данный тип химической связи.
Главное отличие ионной и ковалентной связи в том, что в ионной связи идет полный перенос электронов от одного атома к другому, а в ковалентной электроны являются общими и разделяются между атомами.
Ионная связь обладает рядом свойств, таких как высокая твердость и хрупкость ионных кристаллов, хорошая проводимость электричества в расплавленном и растворенном состоянии, а также хорошая растворимость в воде.
Ионная связь имеет важное значение и находит широкое применение в различных отраслях, от производства солей до электрохимии.
Рассмотрим схему образования ионной связи на примере соединения фторида натрия:
2Na + F2 = 2NaF
Силы электростатического взаимодействия направлены от данного иона во все стороны, поэтому этот ион может притягивать ионы с противоположным знаком в любом направлении, что проиллюстрировано на рисунке 3 ниже.
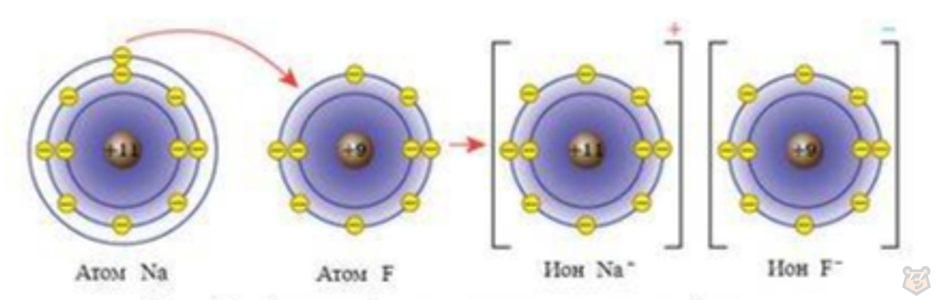
Рисунок 3 — Взаимодействие атомов натрия и фтора
Происходит переход электрона от атома натрия к атому фтора. Оба иона — натрий и фтор — обладают устойчивыми электронными конфигурациями. Этим обусловлены ненаправленность и ненасыщаемость такого типа связи.
Так, в кристаллической решетке фторида натрия NaF каждый ион натрия Na+ окружен шестью фторид-ионами, а каждый фторид-ион — шестью ионами натрия. Строение кристалла фторида натрия представлено на рисунке 4 ниже.

Рисунок 4 — Строение кристалла фторида натрия
Таким образом, весь кристалл фторида натрия образует гигантскую молекулу, которая имеет в составе большое число ионов (Na+F—)n, вследствие чего для ионных соединений определение простых двухатомных молекул при обычных условиях не имеет смысла.
Существуют соединения, содержащие и ионные, и ковалентные связи. К ним относятся щелочи и многие соли. Так, в молекулах гидроксида натрия NaOH и сульфата натрия Na2SO4 между атомами натрия и кислорода имеются ионные связи, а остальные связи (H-О в NaOH и между S-O в Na2SO4) — ковалентные полярные. Органические соединения в большинстве случаев содержат ковалентные связи, где атомы углерода делят пары электронов с другими атомами. Однако ионная связь имеет место в органических солях RCOONa+, ROK+ и основаниях R4N+OH—.
Металлическая связь. Данный тип химической связи характерен для металлов и сплавов. Большинство элементов (свыше 90) относятся именно к металлам.
Металлами называют вещества, обладающие высокой электро- и теплопроводностью, ковкостью, пластичностью, и металлическим блеском.
Для атомов металлов характерно наличие на внешнем энергетическом уровне от одного до трех электронов, например, один у натрия, два у магния и три у алюминия. У некоторых металлов располагаются четыре или пять электронов. Например, Sn — 5s25p2, Bi — 6s26p3).
Для металлов характерна легкая отдача своих валентных электронов, которая возрастает с уменьшением числа электронов на внешнем энергетическом уровне и с удалением внешнего энергетического уровня от атомного ядра.
Следовательно, с ростом порядкового номера элемента способность отдавать электроны и металличность в периодах уменьшается, а в подгруппах увеличивается.
Следовательно, в соединениях металлы могут выступать только в качестве катионов, являясь восстановителями в реакциях окисления-восстановления. Эти свойства металлов широко используются в химической промышленности и лаборатории для проведения различных химических реакций.
Также атомы металлов имеют характерный блестящий металлический блеск ввиду того, что свободные электроны в них могут свободно поглощать и излучать свет.
Оторвавшиеся от атомов электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими заряженными частицами образуется особый тип химической связи — металлическая.
Эта связь обусловливает образование металлической кристаллической решетки простых веществ металлов. В узлах этих решеток имеются положительно заряженные ионы металлов, а между ними передвигаются свободные электроны.
Электроны непрерывно движутся, и при их столкновении с ионами металлов последние превращаются в нейтральные атомы, а затем вновь в ионы, поэтому ионы металлов в кристаллической решетке, окруженные подвижными электронами, получили название ион-атомов в отличие от обычных ионов.
Связь, которую осуществляют относительно свободные электроны между ионами металлов, образующих металлическую кристаллическую решетку, называют металлической связью.
Строение металлической кристаллической решетки представлено на рисунке 5 ниже.
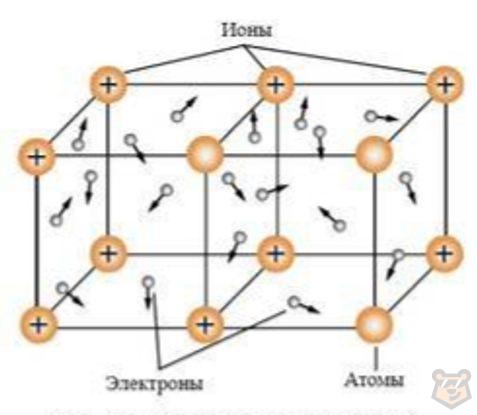
Рисунок 5 — Строение металлической кристаллической решетки
Водородная связь. Химические связи образуются не только между атомами, но также и между молекулами. Одним из таких видов является водородная связь. Данный тип химической связи образуется между атомами водорода и электроотрицательными атомами, такими как кислород, азот или фтор. Электростатический механизм включает в себя притяжение положительно заряженного водорода к отрицательно заряженному атому.
Водородные связи также характерны для таких веществ, как вода, аммиак, фтороводород, спирты, уксусная кислота, также широко распространены в природе, например в белках, нуклеиновых кислотах.
Водородная связь — это связь между положительно заряженным атомом водорода одной молекулы (части молекулы) и отрицательно заряженным атомом другой молекулы (другой части молекулой).
Донорно-акцепторный механизм включает в себя обмен электронной плотности между водородом и электроотрицательным атомом, что создает дополнительную стабильность связи. Следовательно, водородная связь сочетает в себе как электростатические, так и донорно-акцепторные характеристики, делая ее одним из самых сильных типов межмолекулярных взаимодействий.
Например, во фтороводороде HF атом фтора имеет большее значение электроотрицательности, поэтому он смещает на себя электронное облако и обретает таким образом значительный эффективный отрицательный заряд. В свою очередь, ядро атома водорода (протон) лишается электронного облака и обретает, наоборот, эффективный положительный заряд. Таким способом происходит образование водородной связи. На рисунке 6 представлена схема образования водородных связей в молекуле фтороводорода.
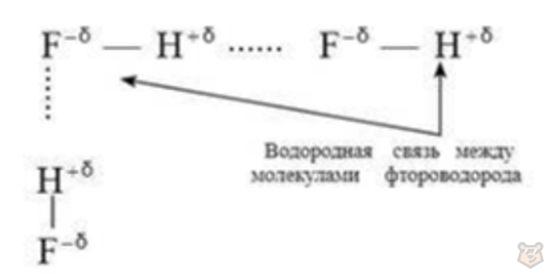
Рисунок 6 — Схема образования водородных связей в молекуле фтороводорода
Такие атомы обладают большим притяжением к электронам, что способствует образованию более сильной водородной связи. Например, вода образует сильные водородные связи с молекулами аммиака и фторида водорода из-за их высокой электроотрицательности и небольших размеров атомов. Это также обусловливает их хорошую растворимость. Например, аммиак с помощью водородных связей имеет большую растворимость в воде: в 1 л воды растворяется 700 л аммиака.
Водородная связь, возникшая между молекулами, называется межмолекулярной. Межмолекулярные водородные связи придают соединению более высокую энергию связи, что требует большего количества энергии для разрушения этих связей и перехода соединения из жидкой фазы в газовую. Поэтому соединения с такими связями имеют более высокие температуры кипения.
Образованием водородных связей объясняется растворимость многих органических соединений в полярных растворителях. Например, в водном растворе происходит гидратация низших спиртов, которая схематично представлена на рисунке 7.
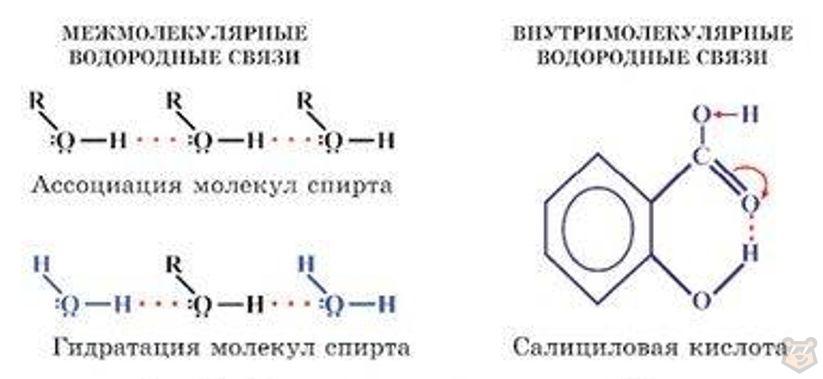
Рисунок 7 — Возникновение межмолекулярной и внутримолекулярной водородной связи
Водородная связь может возникать внутри одной молекулы, такая связь называется внутримолекулярной водородной связью. Внутримолекулярные связи встречаются в органических веществах. Например, внутримолекулярная водородная связь в молекуле салициловой кислоты возникла за счет наличия в гидроксильной группе -ОН с частично положительным зарядом водорода (Нδ+) и в карбоксильной группе -СООН кислорода, который имеет неподеленные электронные пары с частично отрицательным зарядом.
Такие молекулы обычно обладают более слабыми межмолекулярными взаимодействиями, что делает их менее стабильными и менее склонными к образованию молекулярных кристаллов или ассоциатов. Такие вещества обычно имеют более высокую молекулярную подвижность и могут легче испаряться или выпариваться при низких температурах.
Примером таких веществ могут быть спирты, которые формируют внутримолекулярные водородные связи, что делает их менее склонными к образованию ассоциатов и более летучими по сравнению с их изомерами.
Водородные связи придают устойчивость молекулам в окружающей среде и имеет важное значение во многих биологических явлениях, таких как идентификация молекул, сворачивание белков, стабилизация двойной спирали ДНК и РНК и др.
Вещества с водородной связью имеют молекулярные кристаллические решетки, например молекула воды. Кристаллическая решетка воды представлена на рисунке 8.
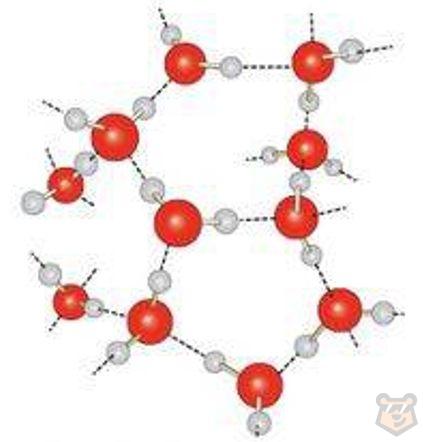
Рисунок 8 — Кристаллическая решетка молекулы воды
Единая природа химической связи. Химические связи могут проявлять различные свойства и взаимодействия в зависимости от типа связи, однако все они имеют определенное единство, которое сводится к взаимодействию между атомами и стремлению достигнуть стабильного состояния.
В реальных веществах обычно присутствует различная степень той или иной химической связи. Например, в металлических соединениях существует комбинация ионных и металлических связей, так как металлы способны отдавать и принимать электроны.
Также в молекулярных соединениях часто наблюдается смешанная связь, где ковалентная и ионная связи сосуществуют в одной молекуле. Например, водный раствор натрия хлорида содержит как ионные связи в решетке кристалла, так и ковалентную связь в молекулярной форме H2O.
Таким образом, в реальных веществах чистые предельные случаи химической связи встречаются не часто, обычно наблюдается комбинация различных типов связей.
Задания для самопроверки:
Задание 1
Ионная связь присутствует в веществе:
А) ZnCl2
B) CO
C) N2
D) NH3
E) HBr
Задание 2
Тип химической связи в молекуле сероводорода:
А) металлическая
B) ионная
C) ковалентная полярная
D) ковалентная неполярная
E) водородная
Задание 3
Ковалентная неполярная связь образуется в:
А) Fe
B) CaO
C) NO2
D) H2
E) HF
Задание 4
Образование водородной связи не характерно для следующего соединения:
А) вода
B) соляная кислота
C) этанол
D) уксусная кислота
E) аммиак
Задание 5
Тип химической связи ковалентная полярная в соединении:
А) I2
B) Li2O
C) CO2
D) Cu
E) HF
Ответы:
1 – A, 2 – C, 3 – D, 4 – B, 5 – C.

